
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl-、Br-、CrO42-B. Br-、Cl-、CrO42-
C. CrO42-、Br-、Cl-D. Br-、CrO42-、Cl-
【答案】B
【解析】
析出沉淀时,AgCl溶液中c(Ag+)=Ksp(AgCl)/c(Cl-)=1.56×10-10/0.01mol·L-1,AgBr溶液中c(Ag+)=Ksp(AgBr)/[Br-]=7.7×10-13/0.01mol·L-1,Ag2CrO4溶液中c(Ag+)=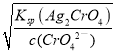 =
=![]() mol·L-1,c(Ag+)越小,先生成沉淀.
mol·L-1,c(Ag+)越小,先生成沉淀.
析出沉淀时,AgCl溶液中c(Ag+)=Ksp(AgCl)/c(Cl-)=1.56×10-10/0.01mol·L-1=1.56×10-8mol·L-1;
AgBr溶液中c(Ag+)=Ksp(AgBr)/[Br-]=7.7×10-13/0.01mol·L-1=7.7×10-11mol·L-1;
Ag2CrO4溶液中c(Ag+)=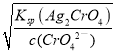 =
=![]() mol·L-1=3×10-5mol·L-1,c(Ag+)越小,先生成沉淀.所以种阴离子产生沉淀的先后顺序为Br-、Cl-、CrO42-。
mol·L-1=3×10-5mol·L-1,c(Ag+)越小,先生成沉淀.所以种阴离子产生沉淀的先后顺序为Br-、Cl-、CrO42-。
故选B。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】物质的分类是学习化学的一种重要方法,科学合理的分类对于提高学习效率、解决问题都有着重要的意义。请回答下列问题:
I. 纯净物根据其组成和性质有如图分类形式
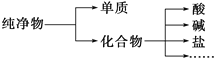
图中所示所属的分类方法为__________________。
II. 有以下13种物质①石墨 ②氧化钠 ③酒精 ④氨水 ⑤二氧化碳 ⑥碳酸氢钠 ⑦氢氧化钠溶液 ⑧纯醋酸 ⑨氯化氢 ⑩硫酸铝 稀硫酸 氯化银 硫酸氢钠
(1)能导电的是 _________;属于非电解质的是 _________。
(2)写出下列物质溶于水的电离方程式:⑥__________;⑧ _________;
(3)写出物质⑥和⑦反应的离子方程式:_________。
(4)写出物质⑥和在水中发生反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化剂与还原剂的判断正确的是( )
A. 反应CH4+2O2![]() CO2+2H2O中,O2是氧化剂,CH4是还原剂
CO2+2H2O中,O2是氧化剂,CH4是还原剂
B. 反应Cl2+2NaOH===NaClO+NaCl+H2O中,Cl2是氧化剂,NaOH是还原剂
C. 反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂
MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂
D. 反应2Na+2H2O===2NaOH+H2↑中,H2O既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是半导体光电化学电池光解水制氢的反应原理示意图。在光照下,电子由价带跃迁到导带后,然后流向对电极。下列说法不正确的是

A. 对电极的电极反应式为:2H++2e-=H2↑
B. 半导体电极发生还原反应
C. 电解质溶液中阳离子向对电极移动
D. 整个过程中实现了太阳能→电能→化学能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2在光照射下可使水分解H2和O2,该过程类似植物的光合作用。如图是光照射下TiO2分解水的装置示意图。下列叙述正确的是( )
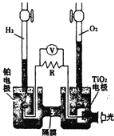
A.该装置可以将光能转化为电能,同时也能转化为化学能
B.铂电极上发生的反应为:H2-2e-=2H+
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,NH3·H2O的电离平衡常数Kb=1.8×10-5,则常温下0.02mol/L的NH4Cl的PH值为( )(lg3=0.48)
A. 4.52B. 5.48C. 3.48D. 8.52
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”.
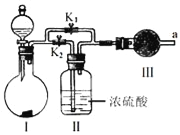
(1)过氧化钠与水反应的化学方程式是__.
(2)装置I是制备纯净的__(填化学式).则装置I中最适宜的试剂组合是__(填字母).
a.稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)实验时,应先打开弹簧夹K2,关闭K1,观察到预期现象后,打开K1,再关闭K2.
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃.
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是__;
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL某物质的量浓度的AlCl3溶液中滴加2mol/LNaOH溶液时,得到的Al(OH)3沉淀质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
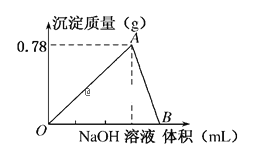
(1)图中A点表示的意义是___,此时消耗NaOH溶液的体积为___mL。
(2)图中B点表示的意义是___,相关反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷和镍均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。与砷同周期的主族元素的基态原子中,第一电离能最大的为_____________(填元素符号。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为__________________________。
②Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3)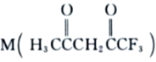 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含![]() 键和π键的数目之比为___________。
键和π键的数目之比为___________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________g·cm-3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com