
【题目】常温下,NH3·H2O的电离平衡常数Kb=1.8×10-5,则常温下0.02mol/L的NH4Cl的PH值为( )(lg3=0.48)
A. 4.52B. 5.48C. 3.48D. 8.52
【答案】B
【解析】
[NH3·H2O]/[NH4+][OH-]为NH3·H2O电离平衡常数的倒数,温度不变,常数不变,NH4Cl溶液中存在NH4++H2O![]() NH3·H2O+H+,结合NH3·H2O电离平衡常数以及Kw计算。
NH3·H2O+H+,结合NH3·H2O电离平衡常数以及Kw计算。
[NH3·H2O]/[NH4+][OH-]为NH3·H2O电离平衡常数的倒数,温度不变,常数不变,已知①NH3·H2O![]() NH4++OH-,Kb=1.8×10-5mol·L-1,②H2O
NH4++OH-,Kb=1.8×10-5mol·L-1,②H2O![]() H++OH-,Kw=1.0×10-14,则②-①可得NH4++H2O
H++OH-,Kw=1.0×10-14,则②-①可得NH4++H2O![]() NH3·H2O+H+,K=1×10-14/1.8×10-5=1/1.8×10-9,则0.02mol·L-1的NH4Cl溶液中c(H+)=
NH3·H2O+H+,K=1×10-14/1.8×10-5=1/1.8×10-9,则0.02mol·L-1的NH4Cl溶液中c(H+)=![]() =
=![]() =1/3×10-5mol·L-1,pH=-lg10-5+lg3=5.48。
=1/3×10-5mol·L-1,pH=-lg10-5+lg3=5.48。
故选B。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,请按要求完成下列题目。
(1)对反应NH3+O2——NO+H2O(未配平)作分析,该反应中,________是还原剂,________是还原产物,被还原的物质是________。
(2)在一定条件下,反应2NH3+3CuO![]() 3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是________。
3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是________。
①该反应是置换反应
②反应中NH3被氧化为N2
③在反应中体现了金属铜的还原性
④该反应中CuO作为氧化剂参与反应
(3) 配平反应:____H2S+___SO2=____S+____H2O。
其中,氧化产物为________,还原剂为________,氧化剂为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,①5 g H2 ②11.2 L O2 ③2 mol H2O ④6.02×1023个 CO2分子。
(1)5gH2 的物质的量是_______,体积是_______;
(2)6.02×1023个CO2分子的物质的量是_____,质量是______;
(3)所含分子数最多的是______(请用序号回答,后同);
(4)所含原子数最多的是______;
(5)质量最大的是_______;
(6)体积最大的是_______;
(7) 体积最小的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl-、Br-、CrO42-B. Br-、Cl-、CrO42-
C. CrO42-、Br-、Cl-D. Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨所需的氢气可用煤和水作原料经过多步反应制得,其中的一步反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H< 0,反应到达平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g) △H< 0,反应到达平衡后,为提高CO的转化率,下列措施中正确的是( )
A. 增加压强B. 降低温度或增大H2O(g)的浓度
C. 增大CO的浓度D. 更换催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验。请回答下列问题:
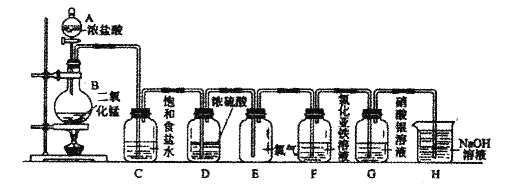
(1)A中盛有浓盐酸,B中盛有MnO2,则烧瓶中发生反应的化学方程式为:
_________________________________________________________
(2)C中盛有饱和食盐水,其作用是________________________________,D中浓硫酸的作用是___________________________________。
(3)F中是FeCl2溶液,F中发生反应的离子方程式为___________________
(4)G中是AgNO溶液,现象是______________________________
(5)H中盛有Na0H溶液,其作用是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4 NH4++6HCHO===3H++6H2O+(CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤III填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数______ (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积______(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察____________
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_______色,且_____________。
(2)滴定结果如下表所示:

若NaOH标准溶液的浓度为0.1010mol·L-1则该样品中氮的质量分数为______
(3)实验室现有3种酸碱指示剂,其pH变色范围如下:
甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0
用0.1000mol/LNaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是__________。
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
(4)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为_________。已知25 ℃时Ksp[Mg(OH)2]=1.8×10—11,Ksp[Cu(OH)2]=2.2×10—20。
(5)在25 ℃下,将a mol·L—1的氨水与0.01 mol·L—1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl—),则溶液显_______性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是( )
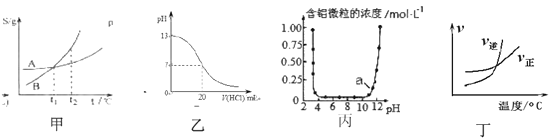
A. 根据图甲(S表示溶解度)表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数A=B
B. 图乙表示25℃时,用0.1mol ·L-1盐酸滴定20mL 0.1mol ·L-1NaOH溶液的pH随加入酸体积的变化
C. 根据图丙表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
D. 根据图丁可判断可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com