
【题目】实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验。请回答下列问题:
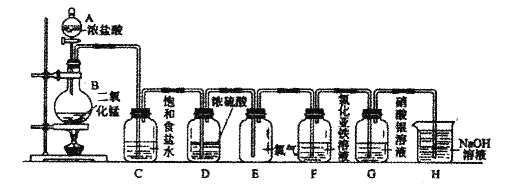
(1)A中盛有浓盐酸,B中盛有MnO2,则烧瓶中发生反应的化学方程式为:
_________________________________________________________
(2)C中盛有饱和食盐水,其作用是________________________________,D中浓硫酸的作用是___________________________________。
(3)F中是FeCl2溶液,F中发生反应的离子方程式为___________________
(4)G中是AgNO溶液,现象是______________________________
(5)H中盛有Na0H溶液,其作用是_____________________________。
【答案】MnO2+ 4HCl(浓)![]() MnCl2+ Cl2↑ + 2H2O 除去氯气中的HCl 干燥氯气(或吸收水分) Cl2+2Fe2+= 2Cl—+ 2Fe3+ 溶液中出现白色浑浊 吸收氯气,防止污染
MnCl2+ Cl2↑ + 2H2O 除去氯气中的HCl 干燥氯气(或吸收水分) Cl2+2Fe2+= 2Cl—+ 2Fe3+ 溶液中出现白色浑浊 吸收氯气,防止污染
【解析】
(1)二氧化锰与浓盐酸加热生成氯化锰、氯气和水,反应的化学方程式为:MnO2+ 4HCl(浓)![]() MnCl2+ Cl2↑ + 2H2O;
MnCl2+ Cl2↑ + 2H2O;
(2)用二氧化锰和浓盐酸共热制得的氯气中混有HCl和H2O(g);氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl﹣+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,用饱和食盐水除去氯气中的HCl;浓硫酸有吸水性,且不和氯气反应,所以可用浓硫酸干燥氯气,
故答案为除去挥发出的HCl气体;干燥氯气;
(3)氯气与氯化亚铁反应生成氯化铁,离子方程式为:Cl2+2Fe2+=2Cl﹣+2Fe3+;
(4)氯水中含有氯离子,氯离子与硝酸银反应生成白色的氯化银沉淀,故答案为溶液中出现白色浑浊;
(5)氯气有毒,污染环境,所以不能直接排空;氯气能和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以可用氢氧化钠溶液吸收多余的氯气;
故答案为吸收氯气,防止污染。


科目:高中化学 来源: 题型:
【题目】根据下图海水综合利用的工艺流程图,判断下列说法正确的是 ( )

已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 过程①的提纯是物理过程
B. 在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
D. 工业上采用向母液中加入烧碱的方法获得氢氧化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是半导体光电化学电池光解水制氢的反应原理示意图。在光照下,电子由价带跃迁到导带后,然后流向对电极。下列说法不正确的是

A. 对电极的电极反应式为:2H++2e-=H2↑
B. 半导体电极发生还原反应
C. 电解质溶液中阳离子向对电极移动
D. 整个过程中实现了太阳能→电能→化学能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,NH3·H2O的电离平衡常数Kb=1.8×10-5,则常温下0.02mol/L的NH4Cl的PH值为( )(lg3=0.48)
A. 4.52B. 5.48C. 3.48D. 8.52
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”.
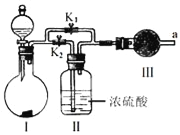
(1)过氧化钠与水反应的化学方程式是__.
(2)装置I是制备纯净的__(填化学式).则装置I中最适宜的试剂组合是__(填字母).
a.稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)实验时,应先打开弹簧夹K2,关闭K1,观察到预期现象后,打开K1,再关闭K2.
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃.
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是__;
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PdCl2广泛用作催化剂和一些物质的检测试剂。由Pd(NH3)2Cl2制备PdCl2工艺流程如图所示。

(1)肼(N2H4)可以被看作二元弱碱,结合质子生成N2H5+或N2H62+。肼与少量稀硫酸混合后,得到产物的化学式为___。
(2)对工艺流程图中的滤液处理办法最好的是:___
a.返到提钯废液中,循环使用 b.转化为无毒物质后排放 c.深埋于地下
(3)王水溶钯时,Pd被氧化为H2PdCl4。同时得到唯一还原产物亚硝酰氯(NOCl)。反应消耗的HCl与HNO3的物质的量之比为___。
(4)赶硝,是将残余的NO3浓度降低到不大于0.04%。实验数据记录如表:
表一:不同HCl用量和MxOy用量(每10gPd)与NO3残留量
HCl用量(mL) | MxOy用量(mL) | NO3含量(%) |
5 | 0、10、20、30、40 | 0.15、0.10、0.05、0.04、0.03 |
10 | 0、5、10、15、20 | 0.10、0.08、0.05、0.03、0.02 |
15 | 0、5、10、15、20 | 0.08、0.06、0.05、0.03、0.02 |
处理1吨Pd,需要用到HCl和MxOy的总体积至少为___m3(合理选择表格里相关数据计算)。
(5)煅烧过程发生分解反应,化学方程式为:___。
(6)浸有磷钼酸铵溶液的氯化钯试纸遇微量CO立即变成蓝色。原理较为复杂,第一步是CO还原PdCl2得到Pd单质,同时有常见的氧化物生成。写出反应原理中第一步的化学方程式:___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL某物质的量浓度的AlCl3溶液中滴加2mol/LNaOH溶液时,得到的Al(OH)3沉淀质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
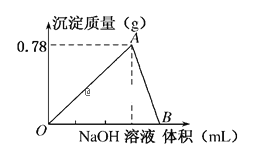
(1)图中A点表示的意义是___,此时消耗NaOH溶液的体积为___mL。
(2)图中B点表示的意义是___,相关反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有等物质的量的NaHCO3和KHCO3的混合物ag与100mL盐酸反应,题中设计的气体体积均以标准状况计,填空时可以用带字母的公式表示。
(1)该混合物中NaHCO3和KHCO3的质量比为:____。
(2)如碳酸氢盐与盐酸恰好完全反应则盐酸的浓度为:____。
(3)如盐酸过量,生成CO2的体积为:____。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量要计算生成的CO2的体积,还需知道:____。
(5)若NaHCO3和KHCO3不是以等物质的量混合,则ag固体混合物与足量的盐酸完全反应时生成CO2的体积范围是:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某未知溶液可能含有Cl-、SO42-、CO32-、Mg2+、Al3+和K+。取100mL该溶液进行实验,过程记录如下。由此可知原溶液中
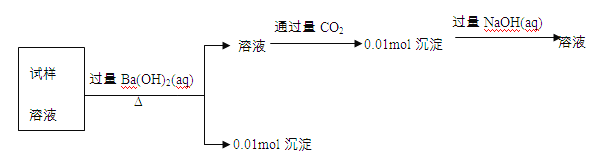
A.一定有Cl- B.一定有CO32- C.一定没有K+ D.一定没有Mg2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com