
【题目】向20mL某物质的量浓度的AlCl3溶液中滴加2mol/LNaOH溶液时,得到的Al(OH)3沉淀质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
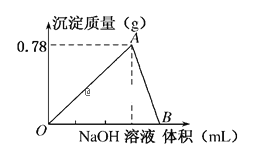
(1)图中A点表示的意义是___,此时消耗NaOH溶液的体积为___mL。
(2)图中B点表示的意义是___,相关反应的离子方程式为___。
【答案】Al3+完全生成Al(OH)3沉淀,沉淀达到最大值 15 Al(OH)3刚好完全溶解,铝元素以AlO2-形式存在 Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O
【解析】
由图可知,随着NaOH溶液的加入,溶液中发生由Al3+→Al(OH)3→AlO2-的转化。
(1)由图象可知,0~A发生AlCl3+3NaOH═Al(OH)3↓+3NaCl,A点时Al3+完全沉淀,图中A点表示的意义是Al3+完全生成Al(OH)3沉淀,沉淀达到最大值;0.78gAl(OH)3的物质的量是![]() 0.01mol,根据反应方程式,消耗氢氧化钠的物质的量是0.03mol,消耗氢氧化钠溶液的体积是
0.01mol,根据反应方程式,消耗氢氧化钠的物质的量是0.03mol,消耗氢氧化钠溶液的体积是![]() 0.015L=15mL。
0.015L=15mL。
(2)由图象可知A~B发生Al(OH)3+NaOH═NaAlO2+2H2O,则B点时Al(OH)3刚好完全溶解;图中B点表示的意义是Al(OH)3刚好完全溶解,铝元素以AlO2-的形式存在;0~A发生反应的离子方程式是Al3++3OH-═Al(OH)3↓、A~B发生反应的离子方程式是Al(OH)3+OH-═AlO2-+2H2O。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】下图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。化合物A是家庭生活中常用的一种调味品,反应①称之为“氯碱工业”。D是黄绿色气体,H的水溶液具有漂白、杀菌性,J为红褐色沉淀。
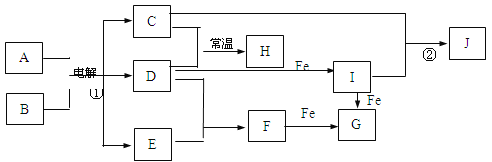
(1)H的化学式为____________。
(2)写出I与Fe反应生成G的离子方程式为_____________________________。
(3)反应①的化学方程式为____________________________________________。
(4)反应②的离子方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl-、Br-、CrO42-B. Br-、Cl-、CrO42-
C. CrO42-、Br-、Cl-D. Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验。请回答下列问题:
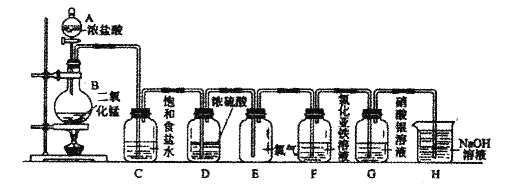
(1)A中盛有浓盐酸,B中盛有MnO2,则烧瓶中发生反应的化学方程式为:
_________________________________________________________
(2)C中盛有饱和食盐水,其作用是________________________________,D中浓硫酸的作用是___________________________________。
(3)F中是FeCl2溶液,F中发生反应的离子方程式为___________________
(4)G中是AgNO溶液,现象是______________________________
(5)H中盛有Na0H溶液,其作用是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 9 B. 16 C. 20 D. 25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4 NH4++6HCHO===3H++6H2O+(CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤III填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数______ (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积______(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察____________
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_______色,且_____________。
(2)滴定结果如下表所示:

若NaOH标准溶液的浓度为0.1010mol·L-1则该样品中氮的质量分数为______
(3)实验室现有3种酸碱指示剂,其pH变色范围如下:
甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0
用0.1000mol/LNaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是__________。
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
(4)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为_________。已知25 ℃时Ksp[Mg(OH)2]=1.8×10—11,Ksp[Cu(OH)2]=2.2×10—20。
(5)在25 ℃下,将a mol·L—1的氨水与0.01 mol·L—1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl—),则溶液显_______性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸60.0mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
实验序号 | I | II | III | IV |
盐酸体积(mL) | 60.0 | 60.0 | 60.0 | 60.0 |
样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
CO2体积(mL) | 672 | 840 | 896 | 672 |
(1)样品中物质的量之比n(NaHCO3):n(Na2CO3)=___。
(2)盐酸的物质的量浓度c(HCl)=___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com