
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 9 B. 16 C. 20 D. 25
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)梯恩梯(TNT)结构简式为____________________________。
(2)![]() 中含有的官能团的名称为_______________。
中含有的官能团的名称为_______________。
(3)戊烷的某种同分异构体只有一种一氯代物,试书写它的结构简式________________________。
(4)某炔烃和氢气充分加成生成2,2,5-三甲基己烷,该炔烃的结构简式是________,名称是____________。
(5)分子式为C6H12的某烃的所有碳原子都在同一平面上,则该烃的结构简式为__________________
(6)分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为_______________。
(7)键线式![]() 表示的分子式为____________,名称是______________________。
表示的分子式为____________,名称是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K 时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色,化学方程式为N2O4 ![]() 2NO2。下列条件的改变对其反应速率几乎无影响的是 ( )
2NO2。下列条件的改变对其反应速率几乎无影响的是 ( )
A. 增加NO2的物质的量 B. 将容器的体积缩小一半
C. 保持体积不变,充入N2使体系压强增大 D. 保持压强不变,充入N2使容器体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄苓素是传统中草药黄答的有效成分之一,其结构如图所示,其对杀伤肿瘤细胞有独特作用。 下列有关汉黄素的叙述正确的是

A. 该物质分子中所有原子有可能在同一平面内
B. 汉黄荃素的分子式为C16H1305
C. 1mol该物质最多可与2 mol Br2发生加成反应
D. 与足量H发生加成反应后,该分子中官能团的种类减少2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示的实验装置进行铁与水蒸气的实验,并研究铁及其化合物的部分性质。
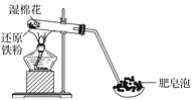
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为______________________。
(2)该同学为确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管的固体物质中一定有___,可能有___;若溶液未变红色,则说明硬质试管中固体物质的成分是___________。
(3)该同学按(2)中所述实验方案进行了实验,结果溶液未变红色,原因是________(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其与NaOH溶液反应。若按图所示操作,可观察到试管中先生成白色沉淀,后沉淀迅速变成灰绿色,最后变成红褐色的现象,请写出白色沉淀变为红褐色的过程中所发生反应的化学方程式:_________________。

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有_____性。由此可知,实验室中含有Fe2+的盐溶液需现用现配制的原因是______,并且配制含Fe2+的盐溶液时应加入少量_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能与电能可相互转化,根据下图回答问题。
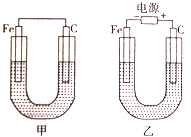
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的______棒,乙装置中的____________棒。(填“铁”或“碳”)
②乙装置中阳极上发生的电极反应式为________________________。
(2)若两装置中均为饱和NaCl溶液:
①甲装置中碳棒上电极反应属于_________________(填“氧化反应”或“还原反应”)。
②乙装置中反应的化学方程式为 __________________。
③若乙装置转移0.1mole-后停止实验,且溶液体积为1L,则溶液混匀后的c(OH-)=_____。(不考虑所生成气体在溶液中的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是

A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)该反应平衡常数的表达式为K=_______________A点处,v(正) ______ v(逆),A点正反应速率 ______ B点正反应速率(用“大于”、“小于”或“等于”填空).
(2)图中表示O2变化的曲线是 ______ .用NO2表示从0~2s内该反应的平均速率v= ______ .

(3) 能说明该反应已经达到平衡状态的是 ______ .
a.NO、O2、NO2的浓度不变
b.v(NO)=2v(O2)
c.NO、O2、NO2的分子数之比为2:1:2
d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是 ______ .
a.适当升高温度b.及时分离出NO2气体
c.增大O2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X元素是地壳中含量最多的元素,Y元素是空气中含量最多的元素,A元素与Y同主族,且是该主族中原子序数最大的非金属元素,D元素位于周期表中第三周期,其最高氧化态可与A形成D3A2。下列说法错误的是
A. 对应酸的酸性:A2X5<A2X3B. 简单离子半径:A>Y>X>D
C. A元素的原子结构示意图: D. 非金属性:X>Y
D. 非金属性:X>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com