
【题目】下面的排序不正确的是( )
A. 晶体熔点由低到高: ![]()
B. 熔点由高到低: ![]()
C. 硬度由大到小:金刚石>碳化硅>晶体硅
D. 晶格能由大到小: ![]()
【答案】B
【解析】
晶体熔沸点高低比较的一般规律是:原子晶体,熔沸点大小和共价键的强弱有关系;金属晶体中,形成金属键的金属阳离子半径越小,电荷数越多,金属键越强,熔沸点越高;分子晶体中形成分子晶体的分子间作用力越大,熔沸点越高;离子晶体中形成离子键的离子半径越小,电荷数越多,离子键越强,熔沸点越高。
A.A中都是分子晶体,熔点和分子间作用力有关系,相对分子质量越大,分子间作用力越强,因相对分子质量CF4<CCl4<CBr4<CI4,则晶体熔点由低到高为:CF4<CCl4<CBr4<CI4,故A排序正确;
B.该组中均为金属晶体,因离子半径Na+<Mg2+<Al3+,且离子所带电荷Na+<Mg2+<Al3+,则熔点由低到高为:Na<Mg<Al,故B排序错误;
C.因原子半径C>Si,则键能C-C>C-Si>Si-Si,硬度由大到小:金刚石>碳化硅>晶体硅,故C排序正确;
D.因Mg2+、Ca2+、O2-所带的电荷数较Na+、 F-、Cl-多,阴阳离子间的晶格能较大,且半径Mg2+>Ca2+、F->Cl-,则有晶格能由大到小为:MgO>CaO>NaF>NaCl,故D排序正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列关于氧化剂与还原剂的判断正确的是( )
A. 反应CH4+2O2![]() CO2+2H2O中,O2是氧化剂,CH4是还原剂
CO2+2H2O中,O2是氧化剂,CH4是还原剂
B. 反应Cl2+2NaOH===NaClO+NaCl+H2O中,Cl2是氧化剂,NaOH是还原剂
C. 反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂
MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂
D. 反应2Na+2H2O===2NaOH+H2↑中,H2O既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计如图实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”.
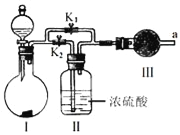
(1)过氧化钠与水反应的化学方程式是__.
(2)装置I是制备纯净的__(填化学式).则装置I中最适宜的试剂组合是__(填字母).
a.稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)实验时,应先打开弹簧夹K2,关闭K1,观察到预期现象后,打开K1,再关闭K2.
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃.
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是__;
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL某物质的量浓度的AlCl3溶液中滴加2mol/LNaOH溶液时,得到的Al(OH)3沉淀质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
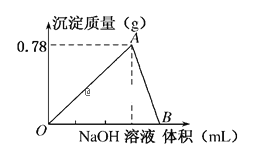
(1)图中A点表示的意义是___,此时消耗NaOH溶液的体积为___mL。
(2)图中B点表示的意义是___,相关反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是( )
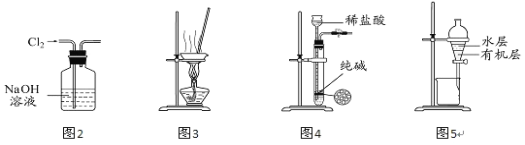
A.用图2所示装置除去Cl2中含有的少量HCl
B.用图3 所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图4 所示装置制取少量纯净的CO2气体
D.用图5 所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有等物质的量的NaHCO3和KHCO3的混合物ag与100mL盐酸反应,题中设计的气体体积均以标准状况计,填空时可以用带字母的公式表示。
(1)该混合物中NaHCO3和KHCO3的质量比为:____。
(2)如碳酸氢盐与盐酸恰好完全反应则盐酸的浓度为:____。
(3)如盐酸过量,生成CO2的体积为:____。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量要计算生成的CO2的体积,还需知道:____。
(5)若NaHCO3和KHCO3不是以等物质的量混合,则ag固体混合物与足量的盐酸完全反应时生成CO2的体积范围是:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
A. 标准状况下,11.2LCH2Cl2中所含C-Cl键的数目与22.4LHF中所含F原子数目相等
B. 1LpH=13的NaOH溶液中含有OH-的数目一定为0.1NA
C. 1mol过氧化钠分别与足量CO2、SO2反应,转移的电子数均为2NA
D. 10g质量分数为46%的乙醇水溶液中含有的氢原子总数为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷和镍均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。与砷同周期的主族元素的基态原子中,第一电离能最大的为_____________(填元素符号。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为__________________________。
②Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3)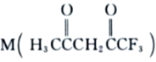 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含![]() 键和π键的数目之比为___________。
键和π键的数目之比为___________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________g·cm-3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com