
【题目】把3mol P和2.5mol Q置于2L密闭容器中,发生如下反应:3P(g)+Q(g)xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(Lmin),下列叙述错误的是( )
A.5min内P的平均反应速率为0.15mol/(Lmin)
B.Q的平衡浓度为1mol/L
C.Q的转化率为25%
D.x是2
【答案】C
【解析】解:A.已知达到平衡生成1molN,则参加反应的P为n(P)= ![]() ×1mol=1.5mol,所以v(P)=
×1mol=1.5mol,所以v(P)= ![]() =0.15 mol/(Lmin),故A正确; B.已知达到平衡生成1molN,则参加反应的Q为n(Q)=
=0.15 mol/(Lmin),故A正确; B.已知达到平衡生成1molN,则参加反应的Q为n(Q)= ![]() n(N)=0.5mol,所以Q的平衡浓度为:
n(N)=0.5mol,所以Q的平衡浓度为: ![]() =1 mol/L,故B正确;
=1 mol/L,故B正确;
C.参加反应的Q为n(Q)= ![]() n(N)=0.5mol,故Q的转化率为:
n(N)=0.5mol,故Q的转化率为: ![]() ×100%=20%,故C错误;
×100%=20%,故C错误;
D.根据A选项可知v(P)=0.15 mol/(Lmin),而M的平均速率是0.1mol/(Lmin),根据速率之比等于化学计量数之比,则: ![]() =
= ![]() ,解得:x=2,故D正确;
,解得:x=2,故D正确;
故选C.
【考点精析】利用化学平衡的计算对题目进行判断即可得到答案,需要熟知反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将6.9g样品溶于足量水中,得到澄清溶液,若再加入过量的CaCl2溶液,得到4.5g沉淀,对样品所含杂质的正确判断是( )
A.肯定有KNO3和Na2CO3 , 没有Ba(NO3)2
B.肯定有KNO3 , 没有Ba(NO3)2 , 可能还有Na2CO3
C.肯定没有Na2CO3和Ba(NO3)2 , 可能有KNO3
D.以上判断都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验). 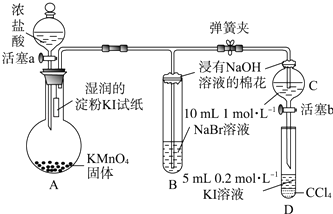
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.…
(1)A中产生黄绿色气体,其电子式是 .
(2)验证氯气的氧化性强于碘的实验现象是 .
(3)B中溶液发生反应的离子方程式是 .
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 .
(5)过程Ⅲ实验的目的是 .
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 , 得电子能力逐渐减弱.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量固体A加入恒容真空容器中发生可逆反应:2A(s)![]() 2B(g)+C (g),下列能说明反应已达平衡状态的是
2B(g)+C (g),下列能说明反应已达平衡状态的是
A. 混合气体的密度保持不变 B. 容器内B、C的浓度之比为2∶1
C. B的生成速率等于C的消耗速率 D. 气体的体积分数保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,有关零排放车载燃料电池叙述正确的是( ) 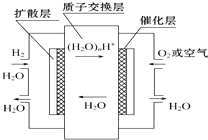
A.正极通入H2 , 发生还原反应
B.负极通入H2 , 发生还原反应
C.总反应式为2H2+O2=2H2O
D.导电离子为质子,且在电池内部由正极定向移向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
①由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
②用排饱和食盐水法收集Cl2
③高压比常压 有利于提高合成氨的产率
④高温下合成氨速率较快
⑤工业制取金属钾Na(l)+ KCl(l) ![]() NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
A. ②③⑤ B. ①②③⑤ C. ①②③④⑤ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒容密闭容器中充入等物质的量的A 和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:

下列说法中正确的是
A. 30 min~40 min 之间该反应使用了催化剂
B. 反应方程式中的x=2,正反应为吸热反应
C. 30 min 时条件的变化是降低压强,40 min 时条件的变化是升高温度
D. 前20 min A 的平均反应速率为0.08 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓硫酸的下列叙述中正确的是( )
A. 浓硫酸具有吸水性,因而能使蔗糖炭化
B. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C. 浓硫酸在酯化反应中仅仅起催化作用
D. 浓硫酸在常温下能够使铁、铝等金属钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一恒温恒压容器中发生如下反应:A(g)+B(g)![]() 2C(g)+D(g)△H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
2C(g)+D(g)△H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是

A. t2时刻改变的条件可能是向密闭容器中加C
B. I、II两过程达到平衡时,A的体积分数I >II
C. 0~t2时,V正>V逆
D. I、II两过程达到平衡时,平衡常数I
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com