
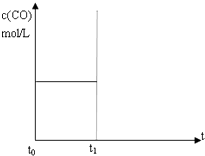
 水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO(g)+H2 (g)△H=+131.3kJ•mol-1
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO(g)+H2 (g)△H=+131.3kJ•mol-1分析 (1)该反应正反应是吸热反应,升高温度平衡向正反应方向移动,据此判断;
(2)将C全部移走,由于是可逆反应,还会生成碳,生成的碳不能完全反应;
(3)依据平衡标志是正逆反应速率相同,各组分含量保持不变,结合反应特征和平衡移动原理分析选项;
(4)①缩小容器体积,压强增大,瞬间正反应速率加快,平衡向逆反应移动,正反应速率增大到新平衡;
②降低温度,瞬间正反应速率减慢,平衡逆反应移动,正反应速率增大到新平衡,据此作图;
(5)依据化学平衡三段式列式计算,转化率=$\frac{消耗量}{起始量}$×100%计算得到;
(6)结合热化学方程式和盖斯定律计算所需热化学方程式得到反应焓变.
解答 解:(1)该反应正反应是吸热反应,升高温度平衡向正反应方向移动,平衡常数增大;
故答案为:增大;
(2)将C全部移走,由于是可逆反应,还会生成碳,生成的碳不能完全反应,故平衡向左移动,
故答案为:向左移;
(3)C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1 ,反应是气体体积增大的放热反应;分析选项正逆反应速率相同是平衡标志;
A.单位体积内每消耗1mol CO的同时生成1molH2 ,说明对一氧化碳或氢气正逆反应速率相同,故A正确;
B.反应前后气体物质的量变化,混合气体总物质的量保持不变说明反应达到平衡状态,故B正确;
C.生成H2O(g)的速率与消耗CO的速率相等只能说明反应逆向进行,不能说明反应达到平衡状态,故C错误;
D.H2O(g)、CO、H2的浓度相等和起始量变化量有关,不能作为平衡标志,故D错误;
故答案为:AB
(4)①缩小容器体积,压强增大,瞬间正反应速率加快,平衡向逆反应移动,正反应速率增大到新平衡;
②降低温度,瞬间正反应速率减慢,平衡逆反应移动,正反应速率增大到新平衡,故图象为: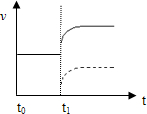 ,故答案为:
,故答案为: ;
;
(5)设H2O转化了xmol/L,依据化学平衡三段式列式计算;
C (s)+H2O(g)?CO (g)+H2 (g)
初始浓度(mol/L) 2.0 0 0
转化浓度(mol/L) x x x
平衡浓度(mol/L) 2.0-x x x
达到平衡时测得lgK=-1.0,K=0.1
K=$\frac{{x}^{2}}{2-x}$=1,解得x=1mol/L
所以α(H2O)=$\frac{1mol/L}{2mol/L}$×100%=50%;
故答案为:50%;
(6)①C (s)+H2O(l)?CO(g)+H2(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③H2O(l)═H2 (g)+$\frac{1}{2}$O2(g)△H3
依据盖斯定律计算①×2+②-2×③得到,C(s)+O2(g)═CO2(g)△H=2△H1+△H2-2△H3;
故答案为:2△H1+△H2-2△H3.
点评 本题考查化学平衡常数及有关计算、化学平衡及反应速率的影响因素、热化学方程式书写等,难度中等,(2)是易错点,学生容易形成定式思维,认为碳是固体,不影响平衡移动,导致错误,注意审题是将碳完全移走.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 某温度下,在恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度均为0.20mol/L,发生反应:H2(g)+CO2(g)?H2O(g)+CO(g).CO(g)的浓度随时间变化如图所示.
某温度下,在恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度均为0.20mol/L,发生反应:H2(g)+CO2(g)?H2O(g)+CO(g).CO(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铯的碱性非常强 | |
| B. | 碱金属单质中铯的沸点最低 | |
| C. | 将一小块铯投入水中,实验现象与钠和水反应的完全相同 | |
| D. | 铯可以与很多非金属反应,形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水中存在下列平衡Br2+H2O?HBr+HBrO,加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 工业上由氢气和氮气合成氨是在较高温度下进行的 | |
| C. | SO2催化氧化成SO3的反应,需要使用催化剂 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
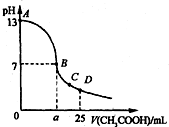 25℃时,在25mL 0.1mol•Lˉ1的NaOH溶液中,逐滴加入0.2mol•Lˉ1的CH3COOH溶液.溶液pH的变化曲线如图所示.下列分析的结论中,错误的是( )
25℃时,在25mL 0.1mol•Lˉ1的NaOH溶液中,逐滴加入0.2mol•Lˉ1的CH3COOH溶液.溶液pH的变化曲线如图所示.下列分析的结论中,错误的是( )| A. | C点时c(CH3COOˉ)>c(Na+)>c(H+)>c(OHˉ) | |
| B. | D点时c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| C. | 曲线上A、B间任一点,溶液中都有:c(Na+)>c(CH3COOˉ)>c(OHˉ)>c(H+) | |
| D. | B点的横坐标a>12.5 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
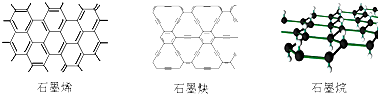
| A. | 石墨烯、石墨炔和石墨烷互为同素异形体 | |
| B. | 12g石墨烯完全转变为石墨烷需氢气11.2L | |
| C. | 石墨炔可作半导体材料,有望替代二氧化硅 | |
| D. | 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
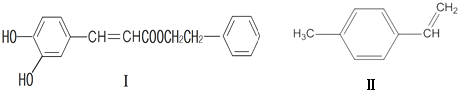
 或
或 (写1种);由Ⅳ生成Ⅱ的反应条件为NaOH的醇溶液、加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为NaOH的醇溶液、加热.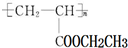 可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.
可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种物质中一定有共价化合物 | B. | 四种物质中一定有Ba(OH)2 | ||
| C. | 丙溶液加热蒸干可得原无水溶质 | D. | 丁溶液中含有HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com