
����Ŀ��40��ʱ���ڰ���ˮ��ϵ�в���ͨ��CO2���������ӵı仯��������ͼ��ʾ������˵������ȷ���ǣ� ��
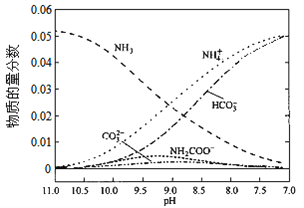
A. ��pH��9.0ʱ��c(NH4+����c(HCO3������c(NH2COO������c(CO32����
B. ��ͬpH����Һ�д��ڹ�ϵ��c(NH4+)��c(H+����2c(CO32������c(HCO3������c(NH2COO������c(OH��)
C. ����Һ��pH���Ͻ��͵Ĺ����У��к�NH2COO�����м��������
D. ����CO2��ͨ�룬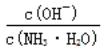 ��������
��������
���𰸡�D
����������ͼ����pH=9�ĵ㣬��һ�����߾Ϳ��Դ����ж���Ũ�ȣ�������c(NH4+����c(HCO3������c(NH2COO������c(CO32������ѡ��A��ȷ��c(NH4+)��c(H+����2c(CO32������c(HCO3������c(NH2COO������c(OH��)����Һ�ĵ���غ����������κ�pH�¶���������ѡ��B��ȷ������pH�Ľ��ͣ�NH2COO����Ũ������˵�������˺���NH2COO���Ļ��������NH2COO����Ũ���ּ�С��˵���û������ֱ���Ӧ��˵������NH2COO���Ļ��������м���ѡ��C��ȷ������һˮ�ϰ��ĵ���ƽ�ⳣ��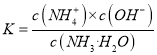 ���õ�
���õ�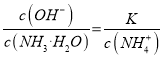 ����Ϊͨ�������̼ʵ�ʾ��Ǽ���̼�ᣬ������c(NH4+)һ������������
����Ϊͨ�������̼ʵ�ʾ��Ǽ���̼�ᣬ������c(NH4+)һ������������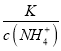 ��С����
��С����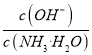 ��С��ѡ��D����
��С��ѡ��D����
�����͡���ѡ��
��������
17
����Ŀ�����������У�A��KI��s�� B��C2H5OH��l�� C��Cl2��g�� D��CH3COOH��l��E��BaSO4��s�� F��NaHSO4��aq����G��ʯī��s����H�����ǣ�s����I��NaOH��l�� J.���� K.����
��1�����ڷǵ���ʵ���____________������ţ���ͬ��������ǿ����ʵ���____________������������ʵ���____________��
��2����ֱ�ӵ������________________���������������ˮ,��ˮ��Һ�ܵ�����________________��
���𰸡� BH AEI J D FGIK ADIJ
������������������������κͻ��ý������������ǵ�����dz��˵����֮������л�������ǿ�������ǿ����ǿ���������������������������ˮ��ע�⣺���ʼȲ��ǵ����Ҳ���Ƿǵ���ʡ���1�����ڷǵ���ʵ����Ҵ������ǣ�ǿ������ǵ⻯�أ��Σ������ᱵ���������ƺ����ᣨע�⣺F������������Һ��K��HCl��Һ�������ڻ�������������Ǵ��ᡣ
��2�����嵼��Ҫ���ǽ�������ʯī������״̬�����Ҫ�������ӻ������Һ����Ҫ������Һ�д�����ֻ���ƶ������ӣ�����ʵ��룩������ֱ�ӵ����������������Һ��ʯī������������Һ�����ᡣ���ڵ���ʣ�������ˮ�����ܵ��磨���������࣬�����������ˮ��������Һһ�����磩���ǵ⻯�ء����ᡢ�������ơ����ᡣ���ᱵ���ܡ�


 ��ǰ�κ�ͬ����ϰϵ�д�
��ǰ�κ�ͬ����ϰϵ�д� ����С��ҵϵ�д�
����С��ҵϵ�д� �Ƹ�С״Ԫ����������ϰ��ϵ�д�
�Ƹ�С״Ԫ����������ϰ��ϵ�д� �ɹ�ѵ���ƻ�ϵ�д�
�ɹ�ѵ���ƻ�ϵ�д� ����ѵ����ֱͨ�п�����ϵ�д�
����ѵ����ֱͨ�п�����ϵ�д� һ���㶨ϵ�д�
һ���㶨ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2L�ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��仯��������ͼ��ʾ����ͼ������
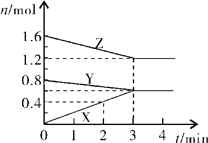
(1)�÷�Ӧ�Ļ�ѧ����ʽΪ_______________��
(2)��Ӧ��ʼ��2minĩ��X�ķ�Ӧ����Ϊ________________mol��L-1��min-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������ͼ��ʾ��������ַ�Ӧ��

�����з�����Ӧ�����ӷ���ʽΪ_____________________________________________��
������ͭ˿�Ϲ۲쵽��������________________________________________________��
�۽����ʵ�������֪Fe2����Cu2����Ag������������ǿ������˳��Ϊ______________________��
��2��ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ5�����ʣ�S��H2S��HNO3��NO��H2O���÷�Ӧ���л�ԭ������____________������Ӧ����ʽ��ת����0.3 mol���ӣ������������������________g��
��3��������Cl2ͨ��FeBr2����Һ�У���Ӧ�����ӷ���ʽΪ2Fe2����Cl2===2Fe3����2Cl���������ʵ˵�����л�ԭ�Ե����ӻ�ԭ��ǿ��Ϊ_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������Ҫʹ�ò����������в�����������ͬ���ǣ� ��
�ٹ��ˣ������������ܽ⣻��������ƿ��ת��Һ�壮
A.�ٺ͢�
B.�ٺ͢�
C.�ۺ͢�
D.�ٺ͢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ����Һ���������ƾ����ϼ��ȿ��Ʊ���������������װ����ȡ����,���õ����Ʊ�Ca3N2,Ca3N2��ˮ����ˮ�ⷴӦ������˵���������
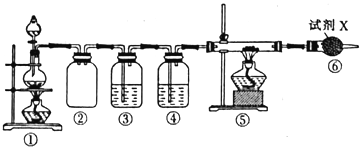
A. ���з����Ļ�ѧ��ӦΪNaNO2+NH4Cl![]() NaCl+N2��+2H2O
NaCl+N2��+2H2O
B. �ܡ���������ʢװ���Լ�������ŨH2SO4����ʯ��
C. ����ʢ�ŵ��Լ���NaOH ��Һ
D. ʵ�����,ȡ���е������������Թ��У�����������ˮ������ʹ�Թܿ�ʪ��ĺ�ɫʯ����ֽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֽ���A��B����֪A��B������Ϊ��̬����A��B�������������������A��B�ۺ϶��ɵĺϽ��ܾ��е�������(���� )
A. ���硢���ȡ���չ�Խϴ�A��B����ǿ
B. ������ΪҺ̬
C. Ӳ�Ƚϴ�����ɻ�
D. �й̶����۵�ͷе�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������糧�ͷų��������������NOx��������������������ɻ�����Ⱦ����ȼú���������ѳ���������ʵ����ɫ��������̼���š��������õ�Ŀ�ġ�
��1����֪��N2 (g) +O2 (g) =2NO (g) ��H=+180.5kJ��mol-1
C (s) +O2 (g)��CO2 (g) ��H=-393.5 kJ��mol-1
2C (s) +O2(g) =2CO (g)��H=-221 kJ��mol-1
��ij��Ӧ��ƽ�ⳣ������ʽΪ�� 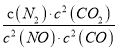 ����д���˷�Ӧ���Ȼ�ѧ����ʽ_________��
����д���˷�Ӧ���Ȼ�ѧ����ʽ_________��
��2������
���ü�����NO2��Ӧ����������Ⱦ�����ʣ���÷�Ӧ�Ļ�ѧ����ʽΪ��___________��
��3����̼
��CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g����H3
CH3OH��g��+H2O��g����H3
��ȡ��ݵ����CO2��H2�Ļ�����壨���ʵ���֮�Ⱦ�Ϊ1:3�����ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״�����������գ�CH3OH���뷴Ӧ�¶�T�Ĺ�ϵ���ߣ�����ͼ1����������CO2ת��Ϊ�״���Ӧ�ġ�H3_____0�����������������=������
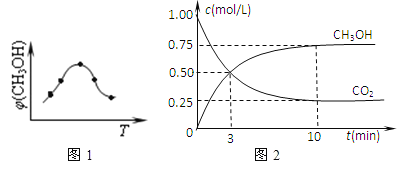
����һ���º����ܱ������г���0.5molCO2��1.5molH2������������Ӧ�����CO2��CH3OH��g����Ũ����ʱ��仯����ͼ2��ʾ����ش𣺵�10min�������£��÷�Ӧ��ƽ�ⳣ����_____����������С���������䡱����������������ٳ���1molCO2��3molH2�ٴδﵽƽ��ʱ����CH3OH��g�������������___�����������С���������䡱����
��4������
ij���������н���������������һ�����İ�������ʪ�Ŀ�����Ӧ����������狀�����淋Ļ������Ϊ����Ʒ���ʣ��������е�SO2��NO2�����ʵ���֮��Ϊ1:1����÷�Ӧ�Ļ�ѧ����ʽΪ__________������0.1mol/L���������Һ�м���������0.09mol/L��ˮ��������pH=8.2����Һ�������Һ����Ũ���ɴ�С��˳��Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��������������Z��Һ�й�����ͼ��ʾ��װ�ã�ʵ���е�����ָ�뷢��ƫת��ͬʱX����֣�Y����ϸ����X��Y��Z��Һ�����������е�(����)
��� | X | Y | Z��Һ |
|
A | Zn | Cu | ϡ���� | |
B | Cu | Zn | ϡ���� | |
C | Cu | Ag | ����ͭ��Һ | |
D | Ag | Zn | ��������Һ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��ʱ����Ӧ����������Ϊ�����ij��Ӧ����Ӧ������Ũ�ȱ仯��ͼ��������ʾ�������������������䣬�¶ȷֱ�ΪT1��T2ʱ��B�����������ʱ��Ĺ�ϵ��ͼ��������ʾ�������н�����ȷ����
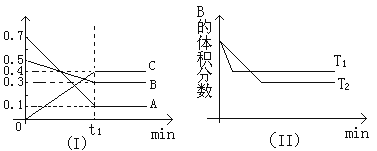
A����t1ʱ������B��ʾ�÷�Ӧ��ƽ������Ϊ��0��6mol��L-1��mim-1
B���ڣ�t1+10��ʱ�����������������䣬����ѹǿ��ƽ�����淴Ӧ�����ƶ�
C��Tʱ������ͬ�����У�����0��1mol��L-1A��0��3mol��L-1B��0��4mol��L-1C��Ӧ���ﵽƽ���C��Ũ����Ϊ0��4mol��L-1
D����������������ʱ�������¶ȣ������淴Ӧ���ʾ�������A��ת��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com