
【题目】某学习小组用0.80 mol/L标准浓度的烧碱溶液测定未知浓度的盐酸。
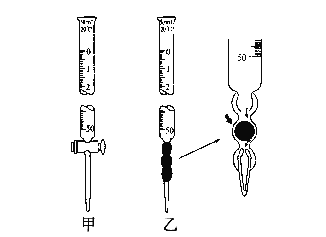
(1).滴定管如图所示,用______滴定管盛装标准浓度的氢氧化钠溶液 (填“甲”或“乙”)。
(2).用滴定的方法来测定盐酸的浓度,实验数据如下所示:
实验编号 | 待测HCl溶液的体积/mL | 滴入NaOH溶液的体积/mL |
1 | 20.00 | 23.00 |
2 | 20.00 | 23.10 |
3 | 20.00 | 22.90 |
该实验中用去标准液的体积为________ml。
(3).下列操作会使所测得的盐酸的浓度偏低的是________。
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
(4).滴定过程中,眼睛应注视________;在铁架台上垫一张白纸,其目的是_______________;
若用酚酞作指示剂,则判断达到滴定终点时的现象是__________________。
(5).根据上表数据,计算被测盐酸的物质的量浓度是________mol/L。(小数点后保留两位有效数字)
【答案】乙 23.00ml D 锥形瓶内溶液颜色的变化 便于观察锥形瓶内液体颜色的变化,减小滴定误差 当滴入最后一滴氢氧化钠溶液,溶液刚好由无色变为粉红色,且半分钟内不恢复原色(或不褪色) 0.92 mol·L-1
【解析】
(1)NaOH溶液显碱性,故应用碱式滴定管盛装标准浓度的氢氧化钠溶液;
(2)根据表格中数据,求出平均消耗V(NaOH);
(3)根据c(待测)=c(标准)V(标准)/V(待测)判断误差;
(4)滴定时,滴定过程中两眼应该注视锥形瓶内溶液的颜色变化;在盛放待测溶液的锥形瓶下方放一张白纸的作用是观察锥形瓶中溶液颜色的变化明显,减少实验误差;当滴入最后一滴氢氧化钠溶液,溶液刚好由无色变为粉红色,且半分钟内不恢复原色(或不褪色);
(5)根据n(HCl)=n(NaOH)计算被测盐酸的物质的量浓度。
(1)NaOH溶液显碱性,故应用碱式滴定管盛装标准浓度的氢氧化钠溶液,故答案为:乙。
(2)根据表格中数据,平均消耗V(NaOH)=(23.00+23.10+22.90)/3mL=23.00mL,故答案为:23.00。
(3)A.盛装待测液的锥形瓶用水洗后未干燥,不会产生误差,故A不符合;
B.滴定前,碱式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=c(标准)V(标准)/V(待测)可知,测定c(HCl)偏大,故B不符合;
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗,测定V(HCl)偏大,根据c(待测)=c(标准)V(标准)/V(待测)可知,测定c(HCl)偏大,故C不符合;
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数,造成V(标准)偏小,根据c(待测)=c(标准)V(标准)V(待测)可知,测定c(HCl)偏低,故D符合。
故答案为:D。
(4)滴定时,滴定过程中两眼应该注视锥形瓶内溶液的颜色变化,在盛放待测溶液的锥形瓶下方放一张白纸的作用是观察锥形瓶中溶液颜色的变化明显,减少实验误差;
当滴入最后一滴氢氧化钠溶液,溶液刚好由无色变为粉红色,且半分钟内不恢复原色(或不褪色),可说明达到滴定终点;
故答案为:锥形瓶内溶液的颜色变化;便于观察锥形瓶内液体颜色的变化,减小滴定误差;
当滴入最后一滴氢氧化钠溶液,溶液刚好由无色变为粉红色,且半分钟内不恢复原色(或不褪色)。
(5)n(HCl)=c(HCl)×20.00mL,n(NaOH)=0.80mol/L×23.00mL,根据反应方程式HCl+NaOH=NaCl+H2O可知,n(HCl)=n(NaOH),
即c(HCl)=0.80mol/L×23.00mL/20.00mL=0.92mol·L-1
故答案为:0.92mol·L-1。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】丁烷的分子结构也可用键线式表示为:![]() ,有机物A的键线式为
,有机物A的键线式为![]() ,A可由有机物B与等物质的量氢气通过加成反应得到。
,A可由有机物B与等物质的量氢气通过加成反应得到。
(1)有机物A的分子式为___________。
(2)有机物A的名称是_______________。
(3)在A 的主链为5个C原子的所有同分异构体中,其分子结构中含有3个甲基的有机物的名称是_______________。
(4)有机物B可能的结构简式有![]() 、_______________、_______________、_______________、_______________。
、_______________、_______________、_______________、_______________。
(5)请写出![]() 在一定条件下,发生加聚反应的化学方程式:_____________________________________________。
在一定条件下,发生加聚反应的化学方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag++ SCN- = AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。

下列说法中,不正确的是
A. ①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B. ②中现象产生的原因是发生了反应Fe(SCN)3 + 3Ag+ = 3AgSCN↓+ Fe3+
C. ③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D. ④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知汽车尾气无害化处理反应为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。下列说法正确的是
N2(g)+2CO2(g)。下列说法正确的是
A.升高温度可使该反应的逆反应速率降低
B.达到化学平衡时,化学反应已经停止
C.v正(NO)=v正(CO2)时,说明达到了化学平衡
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质结构相关知识,回答下列问题:
(1)在第三周期的元素中,第一电离能介于Mg与Cl之间的有_____种。
(2)碳元素与氮元素形成的某种晶体的晶胞如图所示,其中8个C原子位于立方体的顶点,4个C原子位于立方体的面心,4个N原子在立方体内。
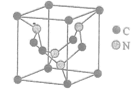
①已知该晶体硬度超过金刚石,其原因是_____。
②晶胞中C原子的杂化方式为_____。
③知该晶胞参数为a nm,阿伏加德罗常数用NA表示,则该晶体的密度为g·cm-3________
(3)大π键可表示为Πmn,其中m代表参与形成的大π键原子数,n表示大π键的电子数,如![]() 的大π键可表示为Π66,则CO32-中的大π键可表示为______。
的大π键可表示为Π66,则CO32-中的大π键可表示为______。
(4)金属铬是一种极硬、耐腐蚀的银白色金属,其化合物种类繁多,如:Cr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+等。
①基态铬原子的价电子排布式为_____。
②配离子[Cr(H2O)3(NH3)3]3+的结构可能有种______。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AIP的熔点为2000℃,其晶胞结构如下图所示。
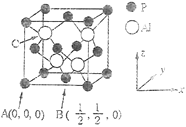
①C点的原子坐标为_____。
②AlP的晶胞中,Al原子位于P原子形成的正四面体空隙中,此空隙的填充率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,

下列说法错误的是
A. B极为原电池的正极
B. A、B、C可能分别为Zn、Cu、稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池。其结构如图所示,放电时的电池反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断下列说法正确的是( )

A.PbO2是电池的负极
B.Pb是电池的负极
C.PbO2得电子,被氧化
D.电池放电时,溶液的酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是( )

A.a点表示的溶液中c(CH3COO-)略小于10-3 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中![]() 均等于K
均等于K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1盐酸分别滴定20.00 mL浓度均为0.10 mol·L-1CH3COONa溶液和NaCN溶液,所得滴定曲线如图(忽略体积变化)。下列说法正确的是( )
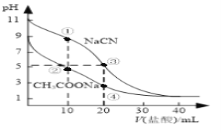
A. 溶液中阳离子的物质的量浓度之和:点②等于点③
B. 点①所示溶液中:c(CN-)+c(HCN)﹤2c(Cl-)
C. 点②所示溶液中:c(Na+)> c(Cl-)> c(CH3COO-)>c(CH3COOH)
D. 点④所示溶液中:c(Na+)+c(CH3COOH)+c(H+)>0.10mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com