
【题目】某元素的原子最外层有2个电子,关于该元素的推断一定正确的是( )
A.是金属元素
B.是IIA族元素
C.是稀有气体元素
D.无法确定
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭燃料,常温下为液体,其分子的球棍模型如下图所示。肼能与双氧水发生反应:N2H4+2H2O2===N2+4H2O。下列说法正确的是

A. 11.2LN2中含电子总数为7×6.02×1023
B. 3.2gN2H4中含有共价键的总数为6×6.02×1022
C. 标准状况下,22.4LH2O2中所含原子总数为4×6.02×1023
D. 若生成3.6gH2O,则上述反应转移电子的数目为2×6.02×1022
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中既属于化合反应,又属于氧化还原反应的是
A. SO2+H2O2===H2SO4 B. SO2+Cl2+2H2O===H2SO4+2HCl
C. CaO+SiO2===GaSiO3 D. CO2+2NaOH===Na2CO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】c(OH﹣)相同的氢氧化钠溶液和氨水,分别用蒸馏水稀释至原体积的m倍和n倍,若稀释后两溶液的c(OH﹣)仍相同,则m和n的关系是( )
A.m>n
B.m=n
C.m<n
D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的原子序号与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是
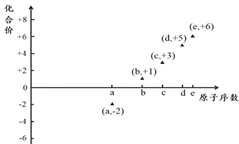
A. 31d和33d属于同种核素 B. 气态氢化物的稳定性:a>d>e
C. 工业上常用电解法制备单质b和c D. a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离平衡曲线如图示,试回答下列问题:

(1)图中五点Kw间的关系是 。
(2)若从A点到D点,可采用的措施是 。
A.升温 B.加入少量的盐酸 C.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 。
(4)B对应温度下,将pH=11的苛性钠溶液V1 L与0.05mol/L的稀硫酸V2L 混合(设混合后溶液的体积等于原两溶液体积之和),所得混合溶液的pH=2,则 V1∶V2=________________。
(5)常温下,将V mL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中充分反应。请回答下列问题(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值___________20.00(填“>”“<”或“=”)。而溶液 中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为___________。
②如果V=40.00,则此时溶液中c(OH-)-c(H+)-c(CH3COOH)=______ ___mol·L-1(填数据)
(6)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)= mol·L-1。(Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用醋酸除去水垢中的碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑
B. 硫化钠水溶液呈碱性的原因:S2-+2H2O![]() H2S↑+2OH-
H2S↑+2OH-
C. 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++OH- +HCO3- =BaCO3↓+ 2H2O
D. 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+=4Fe3++3O2↑+10H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NaCl等为原料制备KClO4的过程如下:
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3=3KClO4+KCl,将产物分离得到KClO4。
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为____________L(标准状况)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是________________。

(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl- (反应为:3 KClO4+C6H12O6 ═ 6 H2O + 6 CO2↑+ 3 KCl),加入少量K2CrO4溶液作指示剂,用0. 20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
① 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)=________________mol/L。
② 计算KClO4样品的纯度(请写出计算过程。)______________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com