
【题目】以NaCl等为原料制备KClO4的过程如下:
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3=3KClO4+KCl,将产物分离得到KClO4。
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为____________L(标准状况)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是________________。

(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl- (反应为:3 KClO4+C6H12O6 ═ 6 H2O + 6 CO2↑+ 3 KCl),加入少量K2CrO4溶液作指示剂,用0. 20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
① 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)=________________mol/L。
② 计算KClO4样品的纯度(请写出计算过程。)______________________________
【答案】1.344低温时,KClO3溶解度小,从溶液中结晶析出1.8×10-6n(AgNO3)=0.2000 mol·-1 ×0.021L=0.0042 mol n(KCl)总=n(AgNO3)=0.0042 mol n(KClO4)+ n(KCl)=0.0042 mol n(KClO4) ×138.5 g·mol-1+ n(KCl) ×74.5 g·mol-1=0.56890g n(KClO4)=0.0040 mol m(KClO4)=0.004 mol×138.5 g·mol-1=0.554g 0.554g÷0.56890g×100%=97.38%。
【解析】
(1)电解时,产生质量为2.13gNaClO3,物质的量=![]() =0.02mol
=0.02mol
NaCl+3H2O=NaClO3 + 3H2↑
1 3
0.02mol 0.06mol
同时得到H2的物质的量为0.06mol,体积=0.06mol×22.4L/mol=1.344L,故答案为:1.344;
(2)在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3的原因是低温时,KClO3溶解度小,从溶液中结晶析出,故答案为:低温时,KClO3溶解度小,从溶液中结晶析出;
(3)①若c(CrO42-)=1.1×10-4mol/L,Ksp(Ag2CrO4)=c2(Ag+)c(CrO4 2-)=1.1×10-12,c(Ag+)=10-4mol/L,Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,c(Cl-)=1.8×10-6 mool/L,故答案为:1.8×10-6;
②准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-(反应为:3KClO4+C6H12O6═6H2O+6CO2↑+3KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/LAgNO3溶液进行滴定至终点,消耗AgNO3溶液体积为21.00mL,n(AgNO3)=0.2000molL-1×0.021L=0.0042mol,n(KCl)总=n(AgNO3)=0.0042mol,n(KClO4)+n(KCl)=0.0042mol,n(KClO4)×138.5gmol-1+n(KCl)×74.5gmol-1=0.56890g,n(KClO4)=0.0040mol,m(KClO4)=0.004mol×138.5gmol-1=0.554g,250ml溶液中m(KClO4)=5.54g,KClO4样品的纯度=![]() ×100%=97.38%,故答案为:97.38%。
×100%=97.38%,故答案为:97.38%。


科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为 C> A> B >D >E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出以下元素的名称 A_________ C_________
(2)B元素在元素周期表中的位置是_______________;D2分子的结构式是______________。
(3)实验室制取D的氢化物的化学反应方程式为_________________________。
(4)用电子式表示化合物A2B的形成过程______________________。
(5)M、N均由A、B、C、E四种元素组成,写出此两种化合物在水溶液中发生反应的离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.SO2通入BaCl2溶液中无现象,加入氨水后得到BaSO4沉淀
B. SO2通入酸性KMnO4溶液中,溶液褪色,体现SO2的漂白性
C.SO2通入紫色石蕊试液中,溶液变红色
D.等物质的量的SO2和Cl2通入水中,溶液的漂白性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏伽德罗常数的值为NA,下列说法正确的是:
A.0.5mol的NaHSO4固体中含有的阴离子总数为NA
B.0.1mol/L FeCl3的溶液中,含Cl-数目为0.3 NA
C.标准状况下22.4LNO2气体与水完全反应时,转移电子数目为NA
D.常温常压下,23gNO2和N2O4的混合气体中总原子数目为1.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)在下列化合物中:H2O 、Na2O 、I2 、NaCl、KOH、CO2、NH4Cl、Na2O2,请填空:
(1)只由非金属组成的离子化合物是________________,
(2)含有极性共价键的离子化合物是________________,
(3)只含有非极性共价键的是______________________,
(4)既有离子键又有非极性键的化合物是___________________。
(Ⅱ)有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如右图所示。E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同。

请回答下列问题:
(1)写出B元素的原子结构示意图_______________________;
(2)A与氢元素能形成原子物质的量之比为1:1的化合物,其电子式为______________;
(3)向D与E形成的化合物的水溶液中滴入NaOH溶液直至过量,观察到的现象是:_______________,最后阶段反应的离子方程式为___________________;
(4)B、C、D、E的最高价氧化物的水化物的酸性从强到弱的顺序为(物质用化学式表示):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。
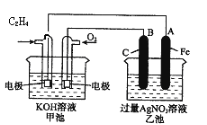
请根据该示意图完成下列题目:
(1)请问:甲池是________装置,乙池是________装置。
(2)在甲池中:通入C2H4的电极名称是___________,通入O2的电极的电极反应式是________。甲池中发生的反应的化学方程式为:________。
(3)在乙池中:B(石墨)电极的名称是________,A(Fe)电极的电极反应式为________。
(4)乙池中反应的化学方程式为________。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2________mL(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水溶液一定呈中性的是
A.c(NH4+)=c(C1-)的NH4Cl 溶液
B.c(H+)=1×10-7mol·L-1的溶液
C.pH=7的溶液
D.室温下将pH=3的酸与pH= 11的碱等体积混合后的溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com