
【题目】已知五种元素的原子序数的大小顺序为 C> A> B >D >E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出以下元素的名称 A_________ C_________
(2)B元素在元素周期表中的位置是_______________;D2分子的结构式是______________。
(3)实验室制取D的氢化物的化学反应方程式为_________________________。
(4)用电子式表示化合物A2B的形成过程______________________。
(5)M、N均由A、B、C、E四种元素组成,写出此两种化合物在水溶液中发生反应的离子方程式____________________________。
【答案】 钠 硫 第二周期第ⅥA族 ![]() 2NH4Cl+Ca(OH)2
2NH4Cl+Ca(OH)2![]() CaCl2+ 2H2O+2NH3↑
CaCl2+ 2H2O+2NH3↑ ![]() H++HSO3-=SO2+H2O
H++HSO3-=SO2+H2O
【解析】A与B形成离子化合物A2B,A2B中所有离子的电子数相同,且电子总数为30,所以每个离子都有10个电子,由化学式的结构可知,B带2个单位负电荷,A带1个单位正电荷,所以A是Na元素,B是O元素,因为A、C同周期,B与C同主族,所以C为S元素;D和E可形成4核10电子的分子,每个原子平均不到3个电子,可知其中一定含有氢原子,分子中有4个原子核共10个电子,一定是NH3,结合原子序数D>E,可知D是N元素,E是H元素,则
(1)由上述分析可知,A为钠,C为硫;(2)氧元素位于第二周期第ⅥA族。氮气的结构式为![]() 。(3)实验室制备氨气的方程式为2NH4Cl+Ca(OH)2
。(3)实验室制备氨气的方程式为2NH4Cl+Ca(OH)2![]() CaCl2+ 2H2O+2NH3↑。(4)A2B是Na2O,由钠离子与氧离子形成的离子化合物,Na2O的形成过程为
CaCl2+ 2H2O+2NH3↑。(4)A2B是Na2O,由钠离子与氧离子形成的离子化合物,Na2O的形成过程为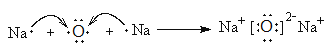 ;(3)M、N均由A、B、C、E四种元素组成,分别是硫酸氢钠和亚硫酸氢钠,两种化合物在水溶液中发生反应的离子方程式为 H++HSO3-=SO2↑+H2O。
;(3)M、N均由A、B、C、E四种元素组成,分别是硫酸氢钠和亚硫酸氢钠,两种化合物在水溶液中发生反应的离子方程式为 H++HSO3-=SO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】已知水的电离平衡曲线如图示,试回答下列问题:

(1)图中五点Kw间的关系是 。
(2)若从A点到D点,可采用的措施是 。
A.升温 B.加入少量的盐酸 C.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 。
(4)B对应温度下,将pH=11的苛性钠溶液V1 L与0.05mol/L的稀硫酸V2L 混合(设混合后溶液的体积等于原两溶液体积之和),所得混合溶液的pH=2,则 V1∶V2=________________。
(5)常温下,将V mL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中充分反应。请回答下列问题(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值___________20.00(填“>”“<”或“=”)。而溶液 中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为___________。
②如果V=40.00,则此时溶液中c(OH-)-c(H+)-c(CH3COOH)=______ ___mol·L-1(填数据)
(6)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)= mol·L-1。(Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用醋酸除去水垢中的碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑
B. 硫化钠水溶液呈碱性的原因:S2-+2H2O![]() H2S↑+2OH-
H2S↑+2OH-
C. 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++OH- +HCO3- =BaCO3↓+ 2H2O
D. 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+=4Fe3++3O2↑+10H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NaCl等为原料制备KClO4的过程如下:
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3=3KClO4+KCl,将产物分离得到KClO4。
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为____________L(标准状况)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是________________。

(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl- (反应为:3 KClO4+C6H12O6 ═ 6 H2O + 6 CO2↑+ 3 KCl),加入少量K2CrO4溶液作指示剂,用0. 20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
① 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)=________________mol/L。
② 计算KClO4样品的纯度(请写出计算过程。)______________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com