
【题目】如图是一个化学过程的示意图。
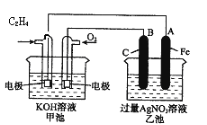
请根据该示意图完成下列题目:
(1)请问:甲池是________装置,乙池是________装置。
(2)在甲池中:通入C2H4的电极名称是___________,通入O2的电极的电极反应式是________。甲池中发生的反应的化学方程式为:________。
(3)在乙池中:B(石墨)电极的名称是________,A(Fe)电极的电极反应式为________。
(4)乙池中反应的化学方程式为________。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2________mL(标准状况下)
【答案】
(1)原电池(或化学能转变为电能);电解池(或电能转变为化学能);
(2)负极;O2+2H2O+4e-=4OH-;C2H4+3O2=2CO2+2H2O和CO2+2KOH=K2CO3+H2O;或C2H4+3O2+4KOH=2K2CO3+4H2O。
(3)阳极;Ag++e-=Ag;
(4)4AgNO3+2H2O4Ag+O2↑+4HNO3;
(5)280。
【解析】
试题分析:(1)根据示意图,甲池是原电池装置,乙池是电解池,故答案为:原电池;电解池;
(2)在甲池中:通入C2H4的电极为负极,C2H4失去电子反应生成碳酸根离子和水,通入O2的电极为正极,正极的电极反应式为O2+2H2O+4e-=4OH-,甲池中发生的反应的化学方程式为C2H4+3O2+4KOH=2K2CO3+4H2O,故答案为:负极;O2+2H2O+4e-=4OH-;C2H4+3O2+4KOH=2K2CO3+4H2O;
(3)在乙池中:B(石墨)与燃料电池的正极相连,为阳极,则A(Fe)电极为阴极,阴极上溶液中的Ag+放电,电极反应式为Ag++e-=Ag,故答案为:阳极;Ag++e-=Ag;
(4)电解硝酸银溶液的反应的化学方程式为4AgNO3+2H2O4Ag+O2↑+4HNO3,故答案为:4AgNO3+2H2O4Ag+O2↑+4HNO3;
(5)5.40g银的物质的量为![]() =0.05mol,转移电子0.05mol,根据得失电子守恒,甲池中理论上消耗O2的物质的量为
=0.05mol,转移电子0.05mol,根据得失电子守恒,甲池中理论上消耗O2的物质的量为![]() =0.0125mol,标准状况下的体积为0.0125mol×22.4L/mol=0.28L=280mL,故答案为:280。
=0.0125mol,标准状况下的体积为0.0125mol×22.4L/mol=0.28L=280mL,故答案为:280。


科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用醋酸除去水垢中的碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑
B. 硫化钠水溶液呈碱性的原因:S2-+2H2O![]() H2S↑+2OH-
H2S↑+2OH-
C. 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++OH- +HCO3- =BaCO3↓+ 2H2O
D. 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+=4Fe3++3O2↑+10H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NaCl等为原料制备KClO4的过程如下:
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3=3KClO4+KCl,将产物分离得到KClO4。
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为____________L(标准状况)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是________________。

(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl- (反应为:3 KClO4+C6H12O6 ═ 6 H2O + 6 CO2↑+ 3 KCl),加入少量K2CrO4溶液作指示剂,用0. 20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
① 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)=________________mol/L。
② 计算KClO4样品的纯度(请写出计算过程。)______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国宋代《开宝本草》中记载了中药材铁华粉的制作方法:“取钢煅作叶如笏或团,平面磨错令光净,以盐水洒之,于醋瓮中阴处埋之一百日,铁上衣生,铁华成矣。”中药材铁华粉是指
A. 铁粉 B. 醋酸亚铁 C. 冰醋酸 D. 食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2FeCl3 +2KI =2FeCl2 +2KCl +I2,2FeCl2 +Cl2 =2FeCl3 ,2KMnO4 +16HCl =2KCl+2MnCl2 +5Cl2↑+ 8H2O。若某溶液中有Fe2+、I-和Cl-,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在和将来的社会,对能源和材料的需求是越来越大,我们学习化学就为了认识物质,创造物质,开发新能源,发展人类的新未来。请解决以下有关能源的问题:
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是:________
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
(2)运动会上使用的火炬的燃料一般是丙烷(C3H8),请根据完成下列题目。
①已知11g丙烷(C3H8)在298K和101Kpa条件下完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式:_____________;
②以丙烷(C3H8)和空气为原料,稀硫酸为电解质溶液_____________(填能或不能)设计成池!
若能,则写出通入丙烷(C3H8)的那一极为:_____________极;氧气在_____________极发生反应。
若不能,则理由是:_____________。
③丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=_______
(3)已知:H—H键的键能为436KJ/mol,H—N键的键能为391KJ/mol,根据化学方程式:N2+3H2![]() 2NH3ΔH=-92.4KJ/mol,
2NH3ΔH=-92.4KJ/mol,
①请计算出N≡N键的键能为_______________。
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入1molN2和3molH2,充分反应后,恢复原温度时放出的热量_______________92.4KJ(填大于或小于或等于)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①MgSO4,②Ba(NO3)2,③NaOH,④CuCl2,⑤KCl五种溶液,不加任何其他试剂,可鉴别且鉴别的先后顺序也正确的是
A.④③②①⑤ B.④⑤③②① C.④③①②⑤ D.④②③①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为 ( )
A.-488.3 kJ/mol B.+488.3 kJ/mol
C.-191 kJ/mol D.+191 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com