
【题目】现有①MgSO4,②Ba(NO3)2,③NaOH,④CuCl2,⑤KCl五种溶液,不加任何其他试剂,可鉴别且鉴别的先后顺序也正确的是
A.④③②①⑤ B.④⑤③②① C.④③①②⑤ D.④②③①⑤
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.SO2通入BaCl2溶液中无现象,加入氨水后得到BaSO4沉淀
B. SO2通入酸性KMnO4溶液中,溶液褪色,体现SO2的漂白性
C.SO2通入紫色石蕊试液中,溶液变红色
D.等物质的量的SO2和Cl2通入水中,溶液的漂白性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。
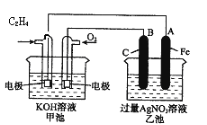
请根据该示意图完成下列题目:
(1)请问:甲池是________装置,乙池是________装置。
(2)在甲池中:通入C2H4的电极名称是___________,通入O2的电极的电极反应式是________。甲池中发生的反应的化学方程式为:________。
(3)在乙池中:B(石墨)电极的名称是________,A(Fe)电极的电极反应式为________。
(4)乙池中反应的化学方程式为________。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2________mL(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
Ⅰ.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
___________________________________________________。
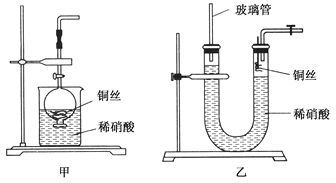
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是____________________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反就开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是___________________________________。
②让反应停止的操作方法及原因是________________________。
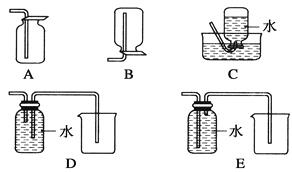
(4)以下收集NO气体的装置,合理的是________(填选项代号)。
(5)假设实验中12.8 g Cu全部溶解,需要通入标况下________mL O2才能使NO全部溶于水。
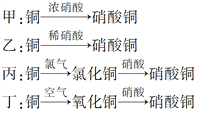
Ⅱ.用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”),理由是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A. 对2HI(g)![]() H2(g)+I2(g)平衡体系增加压强使颜色变深
H2(g)+I2(g)平衡体系增加压强使颜色变深
B. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g)△H<0升高温度使平衡向逆方向移动[
CO2(g)+NO(g)△H<0升高温度使平衡向逆方向移动[
C. 合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3(g)△H<0,为使氨的产率提高,理论上应采取低温高压的措施
D. 在溴水中存在如下平衡:Br2(g)+H2O(l)![]() HBr(aq)+HBrO(aq),当加入NaOH溶液后颜色变浅]
HBr(aq)+HBrO(aq),当加入NaOH溶液后颜色变浅]
查看答案和解析>>
科目:高中化学 来源: 题型:
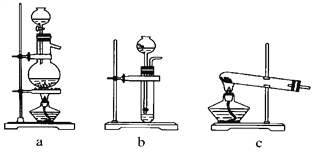
【题目】实验室模拟合成氨和氨催化氧化的流程如下:

已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从如图中选择制取气体的合适装置:氮气________、氢气________。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有________、________。

(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,________(“会”或“不会”)发生倒吸,原因是_________________。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是________,锥形瓶中还可观察到的现象是____________________________。
(5)写出乙装置中氨氧化的化学方程式:_____________________________________________。
(6)反应结束后锥形瓶内的溶液含有H+、OH-、______、________离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水溶液一定呈中性的是
A.c(NH4+)=c(C1-)的NH4Cl 溶液
B.c(H+)=1×10-7mol·L-1的溶液
C.pH=7的溶液
D.室温下将pH=3的酸与pH= 11的碱等体积混合后的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述不正确的是( )
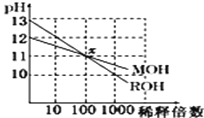
A. MOH是一种弱碱
B. 在x点,c(M+)=c(R+)
C. 稀释前,c(ROH)="10" c(MOH)
D. 稀释前MOH溶液和ROH溶液中由水电离出的c(OH﹣)后者是前者的 10倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步电解制取电解二氧化锰(EMD)的工艺流程如下:
I.将软锰矿、黄铁矿和硫酸按一定比例放入反应釜中,搅拌,加热保温反应一定时间。
II.向反应釜中加入MnO2、CaCO3试剂,再加入Na2S溶液除掉浸出液中的重金属。
III.过滤,向滤液中加入净化剂进一步净化,再过滤,得到精制MnSO4溶液。
IV.将精制MnSO4溶液送入电解槽,电解制得EMD。
请回答下列问题:
(1)步骤I中搅拌、加热的目的是________。完成酸浸过程中反应的离子方程式:
![]() FeS2+
FeS2+![]() MnO2+
MnO2+![]() _____=
_____=![]() Mn2++
Mn2++![]() Fe2++ S + SO42-+
Fe2++ S + SO42-+![]() ____
____
(2)加入CaCO3将浸出液pH调至pH=5,从而除掉铁,请解释用CaCO3除铁的原理:________。(结合离子方程式解释)
(3)步骤IV中用如图所示的电解装置电解精制的MnSO4溶液,生成EMD的是__极(填“a”或“b”),生成EMD的电极反应式是_________。
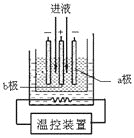
(4)EMD可用作碱性锌锰电池的材料。已知碱性锌锰电池的反应式为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。
下列关于碱性锌锰电池的说法正确的是_______(填字母序号)。
A.碱性锌锰电池是二次电池
B.碱性锌锰电池将化学能转化为电能
C.正极反应为:2MnO2+2H2O+2e-=2MnOOH+2OH-
D.碱性锌锰电池工作时,电子由MnO2经外电路流向Zn极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com