
【题目】在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为 ( )
A.-488.3 kJ/mol B.+488.3 kJ/mol
C.-191 kJ/mol D.+191 kJ/mol
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。
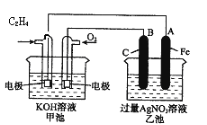
请根据该示意图完成下列题目:
(1)请问:甲池是________装置,乙池是________装置。
(2)在甲池中:通入C2H4的电极名称是___________,通入O2的电极的电极反应式是________。甲池中发生的反应的化学方程式为:________。
(3)在乙池中:B(石墨)电极的名称是________,A(Fe)电极的电极反应式为________。
(4)乙池中反应的化学方程式为________。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2________mL(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水溶液一定呈中性的是
A.c(NH4+)=c(C1-)的NH4Cl 溶液
B.c(H+)=1×10-7mol·L-1的溶液
C.pH=7的溶液
D.室温下将pH=3的酸与pH= 11的碱等体积混合后的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述不正确的是( )
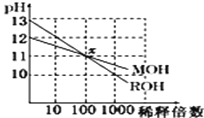
A. MOH是一种弱碱
B. 在x点,c(M+)=c(R+)
C. 稀释前,c(ROH)="10" c(MOH)
D. 稀释前MOH溶液和ROH溶液中由水电离出的c(OH﹣)后者是前者的 10倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷和其化合物在科研及生产中均有着重要的作用。
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)PCl5(g),反应过程如下:
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
气态 PCl5生成气态PCl3和Cl2的热化学方程式为________。
(2)一定温度下,在三个恒容体积均为2.0L的容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始/mol | 平衡/mol | 达到平衡所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
I | 320 | 0.40 | 0.10 | 0.10 | t1 |
II | 320 | 0.80 | t2 | ||
III | 410 | 0.40 | 0.15 | 0.15 | t3 |
①平衡常数K:溶液II____溶液III(填“>”或“=”或“<”)
②反应达到平衡时,PCl3的转化率:容器II_____容器I(填“>”或“=”或“<”)
(3)亚磷酸(H2PO5)与足量的NaOH溶液反应生成Na2HPO3。电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如图:

阴极的电极反应式为_______;产品室中反应的离子方程式为__________。
(4)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO3,先生成________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于105mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c= ______mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年10月17日,我国成功发射神舟十一号载人飞船,飞船高速进入大气层后,温度会迅速升高,其表层的复合材料可保护飞船不受破坏。这体现了该复合材料具有的特点是
A.耐酸性 B.耐热性 C.耐腐蚀 D.耐碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体。已知:A(s)+B(g)=C(g)+D(g) ΔH= +131.4 kJmol-1,某同学实验测知,4 g A发生上述反应吸收43.8 kJ的热量。
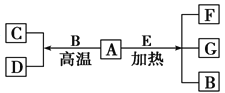
(1)写出A元素的名称________。
(2)另外知:
A(s)+O2(g)=G(g)ΔH= -393.6 kJmol-1
C(g)+ O2(g)=G(g)ΔH=-283 kJmol-1
D(g)+ O2(g)=B(g)ΔH=-242 kJmol-1由此判断“因为283 kJmol-1+242 kJmol-1>393.6 kJmol-1,所以A燃烧时加少量B可以放出更多的热量”这种说法是否正确?___________,理由是_____________________;
(3)写出A+O2→C的热化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步电解制取电解二氧化锰(EMD)的工艺流程如下:
I.将软锰矿、黄铁矿和硫酸按一定比例放入反应釜中,搅拌,加热保温反应一定时间。
II.向反应釜中加入MnO2、CaCO3试剂,再加入Na2S溶液除掉浸出液中的重金属。
III.过滤,向滤液中加入净化剂进一步净化,再过滤,得到精制MnSO4溶液。
IV.将精制MnSO4溶液送入电解槽,电解制得EMD。
请回答下列问题:
(1)步骤I中搅拌、加热的目的是________。完成酸浸过程中反应的离子方程式:
![]() FeS2+
FeS2+![]() MnO2+
MnO2+![]() _____=
_____=![]() Mn2++
Mn2++![]() Fe2++ S + SO42-+
Fe2++ S + SO42-+![]() ____
____
(2)加入CaCO3将浸出液pH调至pH=5,从而除掉铁,请解释用CaCO3除铁的原理:________。(结合离子方程式解释)
(3)步骤IV中用如图所示的电解装置电解精制的MnSO4溶液,生成EMD的是__极(填“a”或“b”),生成EMD的电极反应式是_________。
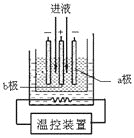
(4)EMD可用作碱性锌锰电池的材料。已知碱性锌锰电池的反应式为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。
下列关于碱性锌锰电池的说法正确的是_______(填字母序号)。
A.碱性锌锰电池是二次电池
B.碱性锌锰电池将化学能转化为电能
C.正极反应为:2MnO2+2H2O+2e-=2MnOOH+2OH-
D.碱性锌锰电池工作时,电子由MnO2经外电路流向Zn极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲是________元素(填元素名称,后面小题相同),它在周期表中的位置为______________。
(2)乙是________元素,写出与乙同主族第六周期元素对应碱的电子式___________________。
(3)丙是________元素,最高价氧化物对应水化物的化学式是_________________;
(4)丁是________元素,甲与丁两种元素形成既有离子键又有共价键物质的化学式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com