
【题目】由氢氧化钠(NaOH)和过氧化钠(Na202)组成混合物中检测出氢元素的质量分数为2.5%,那么混合物中钠元素的质量分数为
A. 46% B. 57.5% C. 58.4% D. 无法计算
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A.SO2、SiO2、CO均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.盐酸、水玻璃、氨水均为混合物
D.烧碱、冰醋酸、四氯化碳均为电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂,既能与Na2CO3溶液反应,又能与NaHCO3的是( )
A.CaCl2溶液
B.BaCl2溶液
C.NaOH溶液
D.Ba(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl===NaCl+H2O;B.Zn+H2SO4===ZnSO4+H2↑。
判断能否设计成原电池A__________,B__________(填“能”或“不能”)。
(2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
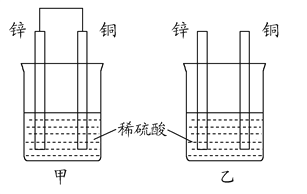
①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲__________乙(填“>”、“<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当乙中产生1.12 L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学实验室用如图所示装置制取少量溴苯。请填写下列空白。

(1)仪器a的名称是______________。在a中装的试剂是苯、溴和铁屑。导管b的作用有两个:一是导气,二是兼起______的作用;铁屑起________________的作用。
(2)锥形瓶内导管不插入液面以下,是为了防止______________。
(3)反应过程中在导管c的下口附近可以观察到白雾出现,这是由于反应生成的________(填化学式)遇水蒸气而形成的。
(4)反应完毕后,向锥形瓶d中滴入AgNO3溶液,有______________________生成,该反应的离子反应方程式是________________________________________。
(5)反应完毕后,将仪器a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有褐色不溶于水的液体。这是溶解了溴的粗溴苯,可选用试剂____________________除去其中的溴。
(6)写出仪器a中发生反应的化学方程式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是

A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Zn和碳棒,则X为碳棒,Y为Zn
C. 若两电极都是金属,则它们的活动性为X>Y
D. X极上发生的是还原反应,Y极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】接触法制硫酸的三个阶段:煅烧、氧化、吸收。煅烧黄铁矿的化学方程式为:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2。
完成下列填空:
(1)煅烧黄铁矿在________(填设备名称)中进行,此反应中被氧化的元素是___________。
(2)SO2的催化氧化:2SO2(g)+O2(g)![]() 2SO3(g),该反应的平衡常数表达式为K= ______;反应达到平衡,及时分离出SO3,则平衡向_________方向移动(选填“正反应”“逆反应”)。其他条件不变,降低温度平衡向正反应方向移动,则正反应为__________反应(选填“吸热”“放热”)。
2SO3(g),该反应的平衡常数表达式为K= ______;反应达到平衡,及时分离出SO3,则平衡向_________方向移动(选填“正反应”“逆反应”)。其他条件不变,降低温度平衡向正反应方向移动,则正反应为__________反应(选填“吸热”“放热”)。
(3)下图为二氧化硫与氧气反应的速率(ν)与时间(t)的关系,判断在t1时刻曲线发生变化的原因是______(选填编号)。

a. 增大O2的浓度
b. 扩大容器体积
c. 加入催化剂
d. 升高温度
改变条件后,平衡混合物中SO3的百分含量_______(选填“增大”“减小”“不变”)。
(4)SO3的吸收:SO3 + H2O → H2SO4 。假定制备硫酸的整个过程中S元素共损失10%,则含1000 kg FeS2的黄铁矿可以制得98%的浓硫酸_____________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列五种有色溶液与SO2作用,均能褪色,其反应实质相同的是( )
①品红溶液 ②酸性KMnO4溶液 ③溴水 ④滴入酚酞的烧碱溶液 ⑤淀粉—碘溶液
A. ①②③ B. ②③④ C. ③④⑤ D. ②③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com