
【题目】在废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。已知:25℃H2S电离常数分别为Ka1=1.3×10—7,Ka2=7.0×10—15,某溶液含0.02mol/LMn2+、0.1mol/LH2S,向该溶液中通入HCl气体或加入NaOH固体以调节溶液pH,(忽略溶液体积的变化、H2S的挥发)。当溶液的pH=5时,Mn2+开始沉淀为MnS,则:
(1)HS—的电离常数表达式为______________;
(2)Na2S溶液中的微粒有_____________种;
(3)NaHS溶液的pH_____________7(填“>”、“=”或“<”),理由是__________________;
(4)当溶液的pH=5时,c(S2—)∶c(H2S)=______________;
(5)MnS的溶度积为_____________;
(6)当Mn2+完全沉淀时,溶液中c(S2—)=____________mol/L。
【答案】K2=![]() 7 > HS-的电离平衡常数Ka2=7.0×10-15,其水解平衡常数Kh=
7 > HS-的电离平衡常数Ka2=7.0×10-15,其水解平衡常数Kh=![]() ≈7.7×10-8>Ka2,说明其水解程度大于电离程度,溶液呈碱性 9.1×10—12 1.82×10—14 1.82×10—9
≈7.7×10-8>Ka2,说明其水解程度大于电离程度,溶液呈碱性 9.1×10—12 1.82×10—14 1.82×10—9
【解析】
(1)HS-电离生成硫离子和氢离子;
(2)Na2S溶液中存在S2-的两步水解及水的电离、硫化钠的电离,据此分析判断;
(3)HS-的电离平衡常数Ka2=7.0×10-15,计算出HS-的水解平衡常数Kh,判断Kh与Ka2的大小关系,再分析判断;
(4)![]() =
=![]() ×
×![]() ×
×![]() ×
×![]() =
=![]() ,据此分析计算;
,据此分析计算;
(5)结合(4)的计算分析计算c(S2-),再结合Ksp(MnS)=c(Mn2+)c(S2-)计算;
(6)当Mn2+完全沉淀时,溶液中c(Mn2+)=10-5 mol/L,结合Ksp(MnS)=c(Mn2+)c(S2-)计算。
(1)HS-电离生成硫离子和氢离子,则HS-的电离常数表达式K2=![]() ,故答案为:
,故答案为:![]() ;
;
(2)Na2S溶液中存在S2-的两步水解及水的电离、硫化钠的电离,所以存在微粒有Na+、S2-、HS-、H2S、H+、OH-、H2O,共有7种微粒,故答案为:7;
(3)HS-的电离平衡常数Ka2=7.0×10-15,其水解平衡常数Kh=![]() ≈7.7×10-8>Ka2,说明其水解程度大于电离程度,溶液呈碱性,则溶液的pH>7,故答案为:>;HS-的电离平衡常数Ka2=7.0×10-15,其水解平衡常数Kh=
≈7.7×10-8>Ka2,说明其水解程度大于电离程度,溶液呈碱性,则溶液的pH>7,故答案为:>;HS-的电离平衡常数Ka2=7.0×10-15,其水解平衡常数Kh=![]() ≈7.7×10-8>Ka2,说明其水解程度大于电离程度,溶液呈碱性;
≈7.7×10-8>Ka2,说明其水解程度大于电离程度,溶液呈碱性;
(4)![]() =
=![]() ×
×![]() ×
×![]() ×
×![]() =
=![]() =
=![]() =9.1×10-12,故答案为:9.1×10-12;
=9.1×10-12,故答案为:9.1×10-12;
(5) =Ka1×Ka2,溶液的pH=5,则溶液中c(S2-)=
=Ka1×Ka2,溶液的pH=5,则溶液中c(S2-)=![]() ×c(H2S)=
×c(H2S)=![]() ×0.1=9.1×10-13,Ksp(MnS)=c(Mn2+)c(S2-)=0.02×9.1×10-13=1.82×10-14,故答案为:1.82×10-14;
×0.1=9.1×10-13,Ksp(MnS)=c(Mn2+)c(S2-)=0.02×9.1×10-13=1.82×10-14,故答案为:1.82×10-14;
(6)当Mn2+完全沉淀时,溶液中c(Mn2+)=10-5 mol/L,溶液中c(S2-)=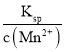 =
=![]() mol/L=1.82×10-9mol/L,故答案为:1.82×10-9。
mol/L=1.82×10-9mol/L,故答案为:1.82×10-9。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】现需配制0.1mol/LNaOH溶液450mL,如图是某同学转移溶液的示意图。
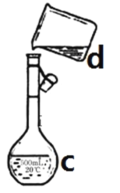
(1)写出下列仪器的名称:c.__________________
(2)图中的错误是____________________________。
(3)根据计算得知,所需NaOH的质量为____________g
(4)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)_______________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在人类的生产和生活中有着广泛的应用,某化学兴趣小组利用图一装置探究氨气的有关性质。
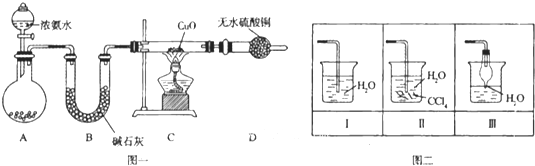
(1)装置A中烧瓶内试剂可选用 (填序号)。B的作用是
a.碱石灰 b.浓硫酸 c.生石灰 d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先 (填I或Ⅱ).
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水 Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为 ,.该反应证明氨气具有 性.
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是 (填装置序号).
(5)氨气极易溶于水,若标准状况下,将2.24L的氨气溶于水配成0.5L溶液,所得溶液的物质的量浓度为 mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaClO、NaClO3的混合液,经测定ClO-和ClO3-的物质的量浓度之比为1∶3,则Cl2与NaOH溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比为
A.21∶5B.11∶3C.3∶1D.4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁(Ⅲ)酸钾制备流程如图所示,下列有关说法不正确的是( )
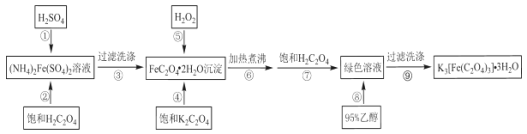
A.在步骤①中加入少量硫酸的目的是防止硫酸亚铁铵的水解,提高草酸亚铁的纯度
B.FeC2O42H2O转化为绿色溶液的离子方程式为:2FeC2O42H2O+H2O2+3C2O42-+H2C2O4=2[Fe(C2O4)3]3-+3H2O
C.在步骤⑥中加热煮沸的目的是为了加快H2O2将亚铁充分氧化为三价铁
D.步骤③与⑨洗涤沉淀的洗涤剂分别可为蒸馏水、无水乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸的结构简式如图,下列有关绿原酸的说法不正确的是
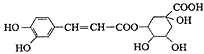
A.分子式为C16H18O9
B.能与碳酸钠溶液发生反应
C.能发生取代反应和消去反应
D.0.1 mol绿原酸最多与含0.6molBr2的浓溴水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:①用物质A表示的反应平均速率为0.3 mol·L-1·s-1 ②2s时物质B的浓度为0.7 mol·L-1③用物质B表示的反应的平均速率为0.6 mol·L-1·s-1 ④2s时物质A的转化率为70%,其中正确的是
2C(g)。若经2s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:①用物质A表示的反应平均速率为0.3 mol·L-1·s-1 ②2s时物质B的浓度为0.7 mol·L-1③用物质B表示的反应的平均速率为0.6 mol·L-1·s-1 ④2s时物质A的转化率为70%,其中正确的是
A.①②B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家合成出了一种由W、X、Y、Z组成的新化合物(如图所示)。W、X、Y、Z为同一短周期元素,W元素焰色为黄色,水体中Y元素含量高会导致水体富营养化,Z的单质常用于给自来水消毒,其核外最外层电子数是X核外电子数的一半。
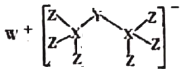
据此回答下列问题:
(1)X在周期表中的位置为_____。
(2)W、Y、Z形成的简单离子半径从大到小的顺序为_____(用离子符号表示)
(3)Y所在主族的元素形成的最简单氢化物,沸点最低的为_____(填化学式),YZ3中所含化学键为_____ (填“离子键”或“共价键”)
(4)写出证明非金属性Z大于X的判据_____ (任写一条)
(5)实验室中制备Z的单质的离子反应方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是一种自然界分布较广的元素,在很多化合物中都含有该元素,回答下列问题:
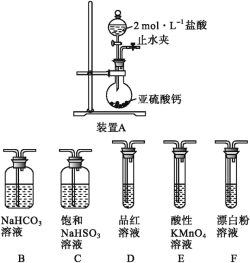
(1)装置A中反应的化学方程式为___。
(2)使分液漏斗中液体顺利流下的操作是___。
(3)选用上面的装置和药品探究亚硫酸与次氯酸的酸性强弱。
①甲同学认为按照A→C→F的顺序连接装置即可证明,乙同学认为该方案不合理,其理由是___。
②丙同学设计的合理实验方案为:A→C→___→___→D→F,其中装置C的作用是___,证明亚硫酸的酸性强于次氯酸的实验现象是___。
(4)K2S2O8具有强氧化性,可通过电解H2SO4和K2SO4的混合溶液制得,其阳极反应式为___,称取0.2500g产品置于碘量瓶中,加100mL水溶解,再加入8.000gKI固体(稍过量),振荡使其充分反应。加入适量醋酸溶液酸化,以淀粉为指示剂,用cmol·L-1的Na2S2O3标准液滴定至终点,消耗Na2S2O3标准液VmL,则样品中K2S2O8的纯度为___(用含c、V的代数式表示,已知:S2O82-+2I-=2SO42-+I2,2S2O32-+I2=S4O62-+2I-)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com