
����Ŀ��ԭ�Ӻ˴Ź�����(NMR)���о��л�������ṹ�������ֶ�֮һ�������о�������ķ����У�ÿһ�ṹ�еĵ�����ԭ�ӣ���NMR���ж���������Ӧ�ķ�(�ź�)�����з��ǿ����ṹ�е���ԭ���������ȡ����磬��ȩ�ĽṹʽΪ ����NMR���������壬ǿ��֮��Ϊ3��1��
����NMR���������壬ǿ��֮��Ϊ3��1��
(1)�ṹ��ʽΪ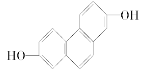 ���л����NMR�Ϲ۲���ǿ��֮��Ϊ________________��
���л����NMR�Ϲ۲���ǿ��֮��Ϊ________________��
(2)ʵ���пɸ���NMR�Ϲ۲쵽����ԭ�Ӹ����ķ�ֵ�����ȷ���л���Ľṹ�������ʽΪC3H6O2����״�л����NMR�Ϸ�������ȶ�ǿ�Ƚ���4�֣����Ƿֱ�Ϊ����3��3����3��2��1����3��1��1��1����2��2��1��1����ֱ��ƶϳ����Ӧ��ȫ���ṹ��
��________________________________��
��________________________________��
��________________________________��
��________________________________��
(3)��û�����CH3CH2CH2CH3��NMR�Ͽɹ۲쵽���ַ壬�����CHCH3CHCH3ʱ��ȴ�õ���ԭ�Ӹ������źŷ�4���������ռ�ṹ���Ͳ���4���źŷ��ԭ��_______________________��
���𰸡�(1)1��1��1��1��1
(2)��CH3COOCH3 ��CH3CH2COOH��HCOOCH2CH3
��![]() ��HO��CH2��CH2��CHO
��HO��CH2��CH2��CHO
(3)��CH3��CH==CH��CH3�����ֿռ�ṹ��
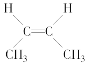 ��
��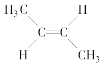 ��ÿ�ֽṹ��NMR�ϸ���2���źŷ壬�ʹ�����4���źŷ�
��ÿ�ֽṹ��NMR�ϸ���2���źŷ壬�ʹ�����4���źŷ�
��������(1)�ؼ������Գ�λ�ã��������л�������5�ֲ�ͬ���͵���ԭ�ӣ�����ԭ������Ϊ2���������ǿ��֮��Ϊ1��1��1��1��1��
(2)�л���C3H6O2���������ᡢ���������ǻ�ȩ������ͬ���칹�弰��NMR�еķ�ǿ��֮�ȷֱ�Ϊ��CH3CH2COOH(3��2��1)��HCOOCH2CH3(1��2��3)��CH3COOCH3(3��3)��![]() (3��1��1��1)��HO��CH2��CH2��CHO(1��2��2��1)���ɴ�ȷ���١��ܵĽṹ��
(3��1��1��1)��HO��CH2��CH2��CHO(1��2��2��1)���ɴ�ȷ���١��ܵĽṹ��
(3)ע�CH3��CH==CH��CH3����˳�����칹�壬���ɻش��⡣


 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д� Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��P4(g)��6Cl2(g)===4PCl3(g) ��H��a kJ��mol��1��
P4(g)��10Cl2(g)===4PCl5(g) ��H��b kJ��mol��1��
��֪�γɻ��1 mol��ѧ���ų������յ�������Ϊ�û�ѧ���ļ��ܡ�P4������������ṹ��PCl5��P��Cl���ļ���Ϊc kJ��mol��1��PCl3��P��Cl���ļ���Ϊ1.2c kJ��mol��1������������ȷ����
A. P��P���ļ��ܴ���P��Cl���ļ���
B. ����Cl2(g)��PCl3(g)===PCl5(s)�ķ�Ӧ����H
C. Cl��Cl���ļ���Ϊ(b��a��5.6c)/4 kJ��mol��1
D. P��P���ļ���Ϊ(5a��3b��12c)/8 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ת���ڸ�����������ʵ�ֵ��ǣ� ��
A.Na ![]() Na2O2
Na2O2 ![]() Na2CO3
Na2CO3
B.MgCO3 ![]() MgCl2��Һ
MgCl2��Һ ![]() Mg
Mg
C.Fe ![]() Fe2O3
Fe2O3 ![]() Fe2��SO4��3
Fe2��SO4��3
D.SiO2 ![]() SiCl4
SiCl4 ![]() Si
Si
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A�����ϣ��������������֪����Է�������Ϊ136������ʽΪC8H8O2��A�ĺ˴Ź���������4���������֮��Ϊ1��2��2��3��A������ֻ��һ�������ұ�����ֻ��һ��ȡ��������˴Ź�����������������ͼ������A������˵���У���ȷ����( )


A��A����������������һ�������²��ܷ���ˮ�ⷴӦ
B��A��һ�������¿���4 mol H2�����ӳɷ�Ӧ
C����������A���ӽṹ�������л���ֻ��1��
D����A����ͬ������ͬ���칹��ֻ��2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л����˵���У���ȷ����
A.ú��������Һ����������ú�ۺ����õ���Ҫ���������ǻ�ѧ�仯
B.�����г��ø������ֶ�ʳƷ��������
C.ʯ�ͷ���õ���ʯ�����и������顢��ϩ������ȿ�ȼ������
D.�ҹ����������䡱���͵�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��I��IV��ʵ������Ԥ����ȷ���ǣ� �� 
A.ʵ��I����εμ�����ʱ���Թ�������������������
B.ʵ��II��ʵ������ȡ���ռ�����
C.ʵ��III���ӱ���ʳ��ˮ����ȡNaCl����
D.װ��IV������KMnO4��Һ�������ݳ��֣�����Һ��ɫ����dzֱ����ȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��������Ҫ�Ļ���ԭ�ϼ��Լ���
��1����0.02mol/L Na2CO3��Һ�м���������CaCl2��Һ����ʼ�г������ɣ�������CaCl2��Һ��Ũ����СΪ
����֪25��ʱKSP��CaCO3��=2.8��10��9����ͨ�����¹��տ��Ƶ����ף�50nm��CaCO3��ĩ����Ƽ�
����ʵ�鷽��֤�������ʵIJ��� ��
��2����֪0.1mol/L NaHCO3��Һ��pH=8��ijѧϰ��ȤС��̽��ʵ�����ƵõĴ������NaCl�������ܺ�����NaHCO3 �� Ϊ�ⶨ����Ĵ��ȣ��õ�����ƽȷ��ȡ��Ʒm�ˣ����������ƿ�У�����������ˮ�ܽ⣬�μ�2�η�̪����c mol/L�ı�����ζ�����Һ��dzɫ�����ɫ���Ұ���Ӳ���ɫ���ζ������������������������������ΪV1mL��
�������ӷ���ʽ���Ǵ�ʱ�����ķ�Ӧ ��
����Ʒ��Na2CO3���������ı���ʽ�� ��
������ƿ��Һ�м����μ�2�μ��ȣ���ͬŨ�ȵ���������ζ����յ㣬������������ΪV2mL���ζ��յ�ʱ����Һ��ɫ�ı仯�� �� �Ұ�����ڲ���ɫ������Ʒ�к� NaHCO3 �� ��V1V2�����������������=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����200mL��Mg2+��Al3+��NH4+��H+��Cl�� �����ӵ���Һ�У���μ���5molL��1NaOH��Һ������NaOH��Һ�������mL����������������ʵ�����mol����ϵ��ͼ��ʾ��������������ȷ���ǣ� �� 
A.x��y=0.01mol
B.ԭ��Һ��c��Cl����=0.75molL��1
C.ԭ��Һ��pH=1
D.ԭ��Һ��n��Mg2+����n��Al3+��=5��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������������Ӧ����4.5gˮ������ͬʱ�ų�60.45kJ���������������Ȼ�ѧ����ʽ��ȷ���ǣ� ��
A.2H2��g��+O2��g��=2H2O��g����H=��483.6kJ/mol
B.2H2��g��+O2��g��=2H2O��l����H=��483.6kJ/mol
C.2H2��g��+O2��g��=2H2O��g����H=��241.8kJ/mol
D.2H2��g��+O2��g��=2H2O��l����H=��241.8kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com