
MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下:

已知:MnCO3难溶于水和乙醇,受热易分解。
⑴ 实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、 。
⑵ ①检验水洗是否合格的方法是 。
②水洗结束后,用乙醇洗涤的目的是 。
⑶ MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。

⑴玻璃棒(1分)
⑵①取最后一次洗涤滤出液少许于一支试管中,向其中滴加盐酸酸化的氯化钡溶液,若无明显现象,说明水洗合格(或其他合理答案) (2分)
②乙醇易挥发,便于低温干燥,防止MnCO3受热分解(1分)
⑶1∶2 (3分) Mn3O4和MnO(或其他合理表达) (3分)
【解析】
试题分析:
⑶设MnCO3的物质的量为1 mol,即质量为115 g
①A点剩余固体质量为115 g×75.65%=87 g
减少的质量为115 g-87 g=28 g
可知MnCO3失去的组成为CO
故剩余固体的成分为MnO2
②C点剩余固体质量为115 g×61.74%=71 g
据锰元素守恒知m(Mn)=55 g,则m(O )1=71 g-55 g=16 g
则n(Mn)∶n(O)= 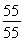 ∶
∶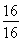 =1∶1
=1∶1
故剩余固体的成分为MnO
同理,B点剩余固体质量为115 g×66.38%=76.337 g
因m(Mn)=55 g,则m(O )2=76.337 g-55 g=21.337 g
则n(Mn)∶n(O)= 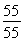 ∶
∶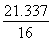 =3∶4
=3∶4
故剩余固体的成分为Mn3O4
因D点介于B、C之间,故D点对应固体的成分为Mn3O4与MnO的混合物。


科目:高中化学 来源:2014年高一下学期化学必修2 1-3-1 离子键练习卷(解析版) 题型:选择题
以下叙述中错误的是( )。
A.钠原子和氯原子作用生成NaCl后,其结构的稳定性增强
B.在氯化钠中,氯离子和钠离子靠静电作用结合
C.任何离子键在形成的过程中必定有电子的得与失
D.金属钠与氯气反应生成氯化钠后,体系能量降低
查看答案和解析>>
科目:高中化学 来源:2014年高一下学期化学必修2 1-1-3 核素练习卷(解析版) 题型:选择题
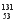 I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中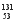 I的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
I的含量变化来监测核电站是否发生放射性物质泄漏。下列有关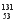 I的叙述中错误的是( )。
I的叙述中错误的是( )。
A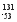 I的化学性质与
I的化学性质与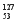 I相同
I相同
B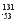 I的原子序数为53
I的原子序数为53
C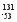 I的原子核外电子数为78
I的原子核外电子数为78
D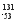 I的原子核内中子数多于质子数
I的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源:2014年高一下学期化学必修2 1-1-1 元素周期表练习卷(解析版) 题型:选择题
某元素X,它的原子最外层电子数是次外层电子数的2倍,则X在周期表中位于( )。
A.第二周期B.第三周期 C.第ⅣA族D.第ⅥA族
查看答案和解析>>
科目:高中化学 来源:2014年高一下化学必修2 3-4-2糖类油脂蛋白质在生活中作用练习卷(解析版) 题型:选择题
构成动物的肌肉、皮肤、血液、乳汁及毛发、蹄脚等物质的主要成分是( )。
A.糖类 B.脂肪 C.蛋白质 D.淀粉
查看答案和解析>>
科目:高中化学 来源:2014年江苏省南通市业水平测试(必修)化学试卷(解析版) 题型:选择题
X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20。下列判断正确的是

A.四种元素的原子半径:rZ>rX>rY>rW
B.四种元素形成的单质最多有6种
C.四种元素均可与氢元素形成电子总数为18的分子
D.四种元素中,Z的最高价氧化物对应的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练四 氧化还原反应的规律与应用练习卷(解析版) 题型:选择题
氯酸是一种强酸,浓度超过40%时会发生分解,该反应可表示为aHClO3―→bO2↑+cCl2↑+dHClO4+eH2O,下列有关说法不正确的是 ( )。
A.由反应可确定氧化性:HClO3>O2
B.由非金属性:Cl>S,可推知酸性:HClO3>H2SO4
C.若氯酸分解所得1 mol混合气体的质量为45 g,则反应的化学方程式可表示为3HClO3===2O2↑+Cl2↑+HClO4+H2O
D.若化学计量数a=8,b=3,则生成3 mol O2时该反应转移20 mol电子
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十七 化学工艺流程题练习卷(解析版) 题型:实验题
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗产品并精制的流程:

根据上述流程回答下列问题:
(1)混合①中发生反应的离子方程式为________________________________。
(2)混合①中使用冰水的目的是_______________________________________。
(3)操作Ⅲ一般适用于分离________混合物。(填序号)
a.固体和液体 b.固体和固体
c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是____________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为其中含有Fe3+,则用于证明该假设所用的试剂为________,若假设成立可观察到的现象为__________________;乙同学假设工业氢溴酸呈淡黄色是因为其中含有________________,其用于证明该假设所用的试剂为____________。
(5)KSCN溶液 溶液变成红色 Br2 CCl4(其他合理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com