
【题目】具有下列电子排布式的原子中,半径最大的是( )
A. ls22s22p63s23p3B. 1s22s22p3
C. 1s22s22p4D. 1s22s22p63s23p4
 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】下列物质的盛放不正确的是( )
A. 烧碱必须密封保存 B. 浓硝酸保存在细口棕色试剂瓶中
C. 金属钠保存在煤油中 D. 氢氧化钠溶液用带玻璃塞的试剂瓶存放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是高中化学重点学习的三大气体之一,它是一种大气污染物,同时也是一种重要的化工原料。

(1)某化学兴趣小组采用图1所示装置制取并探究SO2气体的某些性质。
①下列实验方案能用图1所示装置制取所需SO2的是__________(填序号)
A.铜与浓硫酸 B.固体硫在纯氧中燃烧
C.Na2SO3溶液与HNO3溶液 D.Na2SO3固体与浓硫酸
②验证c中生成SO2的实验方案:向试管d中加入_____后,打开活塞b,反应开始,待d中溶液________后,再______(填实验操作)d中的溶液,溶液________(填实验现象),则说明气体是SO2。
③图1所示装置存在一个明显的缺陷,请用文字说明改进方案:______________。
(2)在图1装置的d试管中加入BaCl2溶液,实验后发现d中有白色沉淀生成。为了探究沉淀的组成,该兴趣小组向d中加入过量稀盐酸,发现沉淀不溶解,你认为该沉淀物是____________,形成该沉淀的主要原因是__________________。为了进一步验证沉淀产生原因,该兴趣小组另取BaCl2溶液并加热煮沸。冷却后及时加入少量苯进行液封,然后再通入SO2,结果发现沉淀量减少,但仍有轻微浑浊产生,该兴趣小组改用图2制气装置再进行实验,结果发现d中没有出现浑浊。
下列气体可作为气体X的是________ (填序号,不定项选择)
A.CO2 B.NH3 C.O3 D.N2 E.NO2
⑶SO2通常作为保护剂添加到葡萄酒,有杀菌、抗氧化、改善风味和增酸的作用,但吸入过量的SO2对人体有害。我国国家标准规定葡萄酒中SO2的最大使用量为0.25g·L-1。图3(固定装置略)为该兴趣小组对葡萄酒中的SO2进行收集与含量测定的装置。
①冷凝管中水的进口为_________(填“e”或“f”)。
②g中加人300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与h中H2O2完全反应,反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按一定的特点或规律对物质进行分类,给化学学习与研究带来很大的方便。下列各组物质中,符合“氧化物—酸—碱—盐”顺序排列的是( )
A.CO HNO3 NaOH KNO3
B.CO2 H2CO3 Na2CO3 Ca(HCO3)2
C.H2SO4 HCl Mg(OH)2 MgCl2
D.SO3 NaHCO3 NaOH Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是( )

A. Ka(HA)=1×10-6mol/L
B. b点c (B+)=c(A-)=c(OH-)=c(H+)
C. c点时,![]() 随温度升高而减小
随温度升高而减小
D. a→c过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃与H2发生加成反应后得到的产物是CH3-CH(CH3)2.
(1)该产物的一氯代物有 _______________种;
(2)原来烯烃的结构简式为: _________________ ;
(3)该烯烃一定条件下发生加聚反应写出加聚产物的结构简式为:_________________;
(4)写出原来的烯烃使溴的四氯化碳溶液褪色的化学反应方程式:
_______________________________________________;
(5) 系统命名法的名称______________________。
系统命名法的名称______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K、100kPa时,已知:H2O(g)=![]() O2(g)+H2(g) △H1
O2(g)+H2(g) △H1
H2(g)+Cl2(g)= 2HCl(g) △H2
2H2O(g)+2Cl2(g)= 4HCl(g)+O2(g) △H3
则△H3与△H1和△H2间的关系正确的是( )
A. △H3 =2△H1+2△H2 B. △H3 =2△H1—△H2
C. △H3 =2△H1—2△H2 D. △H3 =2△H1+△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是:( )
A. SO2、SO3都是极性分子
B. 在 [Cu(NH3)4]2+中存在配位键而NH4+中不存在配位键
C. 元素电负性越大的原子,吸引电子的能力越强
D. 物质的沸点按HF、HCl、HBr、HI的顺序依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)的单质和化合物在化工生产等方面具有重要应用。
(1)下列关于碲及其化合物的叙述不正确的是_______。
A.Te位于元素周期表的第五周期ⅣA族
B. Te的氧化物通常有TeO2和TeO3
C. H2TeO4的酸性比H2SO4酸性强
D.热稳定性H2Te比H2S弱,H2Te比HI强
(2)25℃时,亚碲酸(H2TeO3)的 ![]() = 1×10-3,
= 1×10-3, ![]() =2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为___________ (
=2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为___________ (![]() ); NaHTeO3的溶液的pH_______7(填“>”、“=”或“<”)。
); NaHTeO3的溶液的pH_______7(填“>”、“=”或“<”)。
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含有TeO2、少量Ag、Au)为原料制备单质碲,其工艺流程如下:
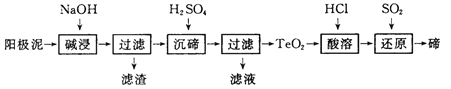
①“碱浸”时TeO2发生反应的化学方程式为 _________。
②“沉碲”时控制溶液的pH为4. 5~5. 0,生成Tea沉淀。酸性不能过强的原因是_________;防止局部酸度过大的操作方法是____________。
③“酸溶”后,将SO2通入TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是____________。
④工业上还可以通过电解铜阳极泥碱浸、过滤后的滤液得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com