
【题目】碲(Te)的单质和化合物在化工生产等方面具有重要应用。
(1)下列关于碲及其化合物的叙述不正确的是_______。
A.Te位于元素周期表的第五周期ⅣA族
B. Te的氧化物通常有TeO2和TeO3
C. H2TeO4的酸性比H2SO4酸性强
D.热稳定性H2Te比H2S弱,H2Te比HI强
(2)25℃时,亚碲酸(H2TeO3)的 ![]() = 1×10-3,
= 1×10-3, ![]() =2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为___________ (
=2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为___________ (![]() ); NaHTeO3的溶液的pH_______7(填“>”、“=”或“<”)。
); NaHTeO3的溶液的pH_______7(填“>”、“=”或“<”)。
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含有TeO2、少量Ag、Au)为原料制备单质碲,其工艺流程如下:
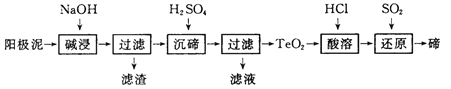
①“碱浸”时TeO2发生反应的化学方程式为 _________。
②“沉碲”时控制溶液的pH为4. 5~5. 0,生成Tea沉淀。酸性不能过强的原因是_________;防止局部酸度过大的操作方法是____________。
③“酸溶”后,将SO2通入TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是____________。
④工业上还可以通过电解铜阳极泥碱浸、过滤后的滤液得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为__________。
【答案】 CD 10% < TeO2+2NaOH=Na2TeO3+H2O 溶液酸性过强,TeO2会继续与酸反应导致碲元素损失 缓慢加入H2SO4,并不断搅拌 TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4 TeO32-+3H2O+4e-=Te+6OH-
【解析】(1)A.Te属于氧族元素,位于周期表中第五周期第VIA族,即Se元素下方,故A正确;B.Te是第VIA族元素,主要化合价为+4价和+6价,则氧化物通常有TeO2和TeO3,故B正确;C.非金属性S>Se,所以最高价氧化物的水化物酸性:H2TeO4<H2SO4,故C错误;D.Te的非金属性比S和I弱,则热稳定性H2Te比H2S、HI弱,故D错误;答案为CD;
(2)弱酸的一级电离为主,H2TeO3![]() HTeO3-+H+,设溶液中H+和HTeO3-的浓度均为xmol/L,则Ka1=
HTeO3-+H+,设溶液中H+和HTeO3-的浓度均为xmol/L,则Ka1=![]() =1×10-3,则x=0.01mol/L,a=
=1×10-3,则x=0.01mol/L,a=![]() ×100%=10%;HTeO3-+H2O
×100%=10%;HTeO3-+H2O![]() H2TeO3+OH-,其水解常数Kb=Kw/Ka1=1×10-11<
H2TeO3+OH-,其水解常数Kb=Kw/Ka1=1×10-11<![]() ,则NaHTeO3的溶液因HTeO3-电离大于其水解,其水溶液的pH<7;
,则NaHTeO3的溶液因HTeO3-电离大于其水解,其水溶液的pH<7;
(3)根据TeO2是两性氧化物,微溶于水,加碱溶过滤除去杂质,得到Na2TeO3溶液,再加硫酸沉降经过滤得到TeO2沉淀,再用盐酸溶解生成四氯化碲,再用二氧化硫还原制成碲单质;
①TeO2是两性氧化物,与氢氧化钠发生类似氧化铝与氢氧化钠的反应,化学方程式为TeO2+2NaOH=Na2TeO3+H2O;
②因为TeO2是两性氧化物,H2SO4过量会导致TeO2继续与H2SO4反应导致损失;防止局部酸度过大的操作方法是:缓慢加入H2SO4,并不断搅拌;
③SO2还原TeCl4为Te,本身被氧化为硫酸,化学方程式为TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4;
④电解铜阳极泥碱浸、过滤后的滤液中含有TeO32-,电解时TeO32-在阴极发生还原反应生成Te,其电极反应式为TeO32-+3H2O+4e-=Te+6OH-。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】具有下列电子排布式的原子中,半径最大的是( )
A. ls22s22p63s23p3B. 1s22s22p3
C. 1s22s22p4D. 1s22s22p63s23p4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去甲烷中的乙烯并得到纯净的甲烷,可依次将其通过洗气瓶
A. 澄清石灰水,浓H2SO4B. 溴水,浓H2SO4
C. 酸性高锰酸钾溶液,浓H2SO4D. 浓H2SO4 ,酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现C60 后,近年又合成了许多球形分子(富勒烯),如C50 、C70 、C120 、C540 等,它们互称为 ( )
A. 同系物 B. 同分异构体 C. 同素异形体 D. 同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是几种常见的化学电源示意图,完成下列问题:

(1)干电池放电时负极发生的电极方程式为____________________。
(2)氢氧燃料电池在酸性电解质环境中放电时氢气在______(填“正”或“负”)极发生______反应(填“氧化”或“还原”),电路中每转移0.4mol电子,标准状况下消耗O2的体积是______L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
Ⅰ.经查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。请设计最简单的方法鉴别NaNO2和NaCl两种固体______________________
Ⅱ. 某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠
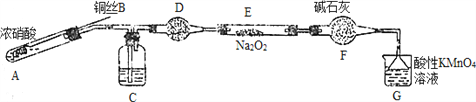
已知:①2NO+Na2O2=2NaNO2; ②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
(1)使用铜丝的优点是________________________。
(2)装置A中发生反应的化学方程式为_____________________________。
装置C中盛放的药品是_________;(填字母代号)
A.浓硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,
用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③该样品中亚硝酸钠的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是4个碳原子相互结合形成的8种有机物(氢原子没有画出)A-H(据此回答下列各题)

(1)有机物E的名称是 (_____)
A.丁烷 B.2-甲基丙烷 C.1-甲基丙烷 D.甲烷
(2)有机物B、C、D互为 (_____)
A.同位素 B.同系物 C.同分异构体 D.同素异形体
(3)每个碳原子都跟两个氢原子通过共价键结合的有机物是(______)
A.B B.F C.G D.H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关自发反应的说法中正确的是
A.自发反应一定是ΔS > 0的反应
B.自发反应一定是ΔH < 0的反应
C.自发反应在任何条件下都能自动进行
D.ΔH < 0,ΔS > 0的反应一定是自发反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com