
【题目】下图是4个碳原子相互结合形成的8种有机物(氢原子没有画出)A-H(据此回答下列各题)

(1)有机物E的名称是 (_____)
A.丁烷 B.2-甲基丙烷 C.1-甲基丙烷 D.甲烷
(2)有机物B、C、D互为 (_____)
A.同位素 B.同系物 C.同分异构体 D.同素异形体
(3)每个碳原子都跟两个氢原子通过共价键结合的有机物是(______)
A.B B.F C.G D.H
【答案】 B C D
【解析】E中只含有碳碳单键和碳氢单键,且含有4个碳原子,故属于丁烷,由于该结构中含有1个甲基,故正确命名为2-甲基丙烷,故选B。
A为丁烷,B为1-丁烯,C为2-丁烯,D为2-甲基-1-丙烯,E为2-甲基丙烷,F为1-丁炔,G为2-丁炔,H为环丁烷;B、C、D的分子式都为C4H8,三者的结构不同,所以它们互为同分异构体,故选C。
A.B中含有处于端点的碳原子,与三个氢原子结合,则不符合题意,故A不选;B.F中含有处于端点的碳原子,与三个氢原子结合,则不符合题意,故B不选;C.G中含有2个处于端点的碳原子,与三个氢原子结合,含有碳碳三键,不与氢原子结合,则不符合题意,故C不选;D.H为环状结构,每个碳原子最多形成4个共价键,由图可知每个碳形成2个碳碳单键,则每个碳原子都跟两个氢原子通过共价键结合,故D选;故选D。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是:( )
A. SO2、SO3都是极性分子
B. 在 [Cu(NH3)4]2+中存在配位键而NH4+中不存在配位键
C. 元素电负性越大的原子,吸引电子的能力越强
D. 物质的沸点按HF、HCl、HBr、HI的顺序依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)的单质和化合物在化工生产等方面具有重要应用。
(1)下列关于碲及其化合物的叙述不正确的是_______。
A.Te位于元素周期表的第五周期ⅣA族
B. Te的氧化物通常有TeO2和TeO3
C. H2TeO4的酸性比H2SO4酸性强
D.热稳定性H2Te比H2S弱,H2Te比HI强
(2)25℃时,亚碲酸(H2TeO3)的 ![]() = 1×10-3,
= 1×10-3, ![]() =2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为___________ (
=2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为___________ (![]() ); NaHTeO3的溶液的pH_______7(填“>”、“=”或“<”)。
); NaHTeO3的溶液的pH_______7(填“>”、“=”或“<”)。
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含有TeO2、少量Ag、Au)为原料制备单质碲,其工艺流程如下:
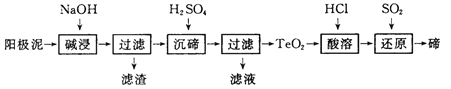
①“碱浸”时TeO2发生反应的化学方程式为 _________。
②“沉碲”时控制溶液的pH为4. 5~5. 0,生成Tea沉淀。酸性不能过强的原因是_________;防止局部酸度过大的操作方法是____________。
③“酸溶”后,将SO2通入TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是____________。
④工业上还可以通过电解铜阳极泥碱浸、过滤后的滤液得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平.现以A为主要原料合成乙酸乙酯,其合成路线如图1所示.
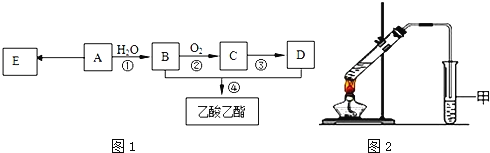
(1)A分子中官能团的名称是______,D中官能团的名称是______;反应①的反应类型是______反应.
(2)反应②的化学方程式是______,反应④的化学方程式是______.
(3)E是常见的高分子材料,合成E的化学方程式是______.
(4)某同学用如图2所示的实验装置制取少量乙酸乙酯.实验结束后,试管甲中上层为透明的、不溶于水的油状液体.
①实验开始时,试管甲中的导管不伸入液面下的目的是______.
②上述实验中饱和碳酸钠溶液的作用是(填字母)______.
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.加速酯的生成,提高其产率
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫的叙述中,正确的是 ( )
A.硫的非金属性较强,故只能以化合态存在于自然界中
B.能与Cu、Fe、O 2 等物质反应,S作氧化剂
C.硫燃烧得SO 3 ,可以制得硫酸
D.S与Cu反应生成Cu 2 S,而不能生成CuS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列玻璃仪器洗涤方法正确的是( )
A.做银镜反应后的试管用氨水洗涤
B.做碘升华实验后的烧杯用酒精洗涤
C.盛装苯酚后的试管用盐酸洗涤
D.用KClO3和MnO2制取O2后的试管用水洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v为
4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v为
A.v(O2)=0.01mol/(L·s) B.v(NO)=0.08mol/(L·s)
C.v(H2O)=0.003mol/(L·s) D.v(NH3)=0.001mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.除去铁粉中混有的少量铝粉,可加入盐酸溶液,完全反应后过滤
B.将钠投人到盛满水的烧杯中,观察钠与水反应实验现象
C.氧化铝的熔点高于铝的熔点
D.实验室配制一定浓度NaOH溶液,将称量固体溶解后马上转移到容量瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com