
【题目】含氮化合物在化学工业中有着重要的应用,回答下列问题:
(1)由N2O和NO反应生成N2和NO2的能量变化(表示生成1molN2的能量变化)如图所示,该反应的热化学方程式为______________________。

(2)一定条件下,硝酸铵加热分解得到的产物只有N2O和H2O。250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的平衡常数表达式为K=___________;若有1mol硝酸铵完全分解,则转移电子的数目为___________(设NA为阿伏加德罗常数的值)。
(3)硝基苯甲酸乙酯在碱性条件下发生反应:O2NC6H4COOC2H5+OH-![]() O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.80mol·L-1,T℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。
t/s | 0 | 60 | 90 | 120 | 160 | 260 | 300 | 360 | 400 |
a/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
①该反应在60~90s与90~120s内的平均反应速率分别约为___________,___________;比较两者大小可得出的结论是______________________。
②计算T℃时该反应的平衡常数为______________________。
③为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施为______________________(写出一条即可)。
【答案】N2O(g)+NO(g)=N2(g)+NO2(g) △H=-139kJ/mol c(N2O)![]() c2(H2O) 4NA 2.35
c2(H2O) 4NA 2.35![]() 10-3mol
10-3mol![]() L-1
L-1![]() s-1 1.87
s-1 1.87![]() 10-3mol
10-3mol![]() L-1
L-1![]() s-1 随着反应的进行,反应物浓度减小,反应速率减慢 6.0(或5.99) 增大OH-的浓度(或移去产物等其他合理答案)
s-1 随着反应的进行,反应物浓度减小,反应速率减慢 6.0(或5.99) 增大OH-的浓度(或移去产物等其他合理答案)
【解析】
(1)由图可知,此反应为放热反应,热效应=(209-348)kJmol-1;
(2)依据所给的反应物和产物,结合元素守恒书写方程式即可,依据反应书写平衡常数表达式,依据氧化还原反应得失电子守恒计算转移电子数;
(3)①反应过程中硝基苯甲酸乙酯浓度的变化量等于其起始浓度与转化率的乘积,再利用求反应速率的计算公式可求出两个时间段内的平均反应速率分别为2.35![]() 10-3mol
10-3mol![]() L-1
L-1![]() s-1,1.87
s-1,1.87![]() 10-3mol
10-3mol![]() L-1
L-1![]() s-1,由此可得出的结论是随着反应的进行,反应物浓度减小导致反应速率降低。
s-1,由此可得出的结论是随着反应的进行,反应物浓度减小导致反应速率降低。
②反应时间达到360 s时,硝基苯甲酸乙酯的转化率不再随时间的变化而发生变化,即反应在360s时达到平衡。此时体系内两种产物浓度为0.80 mol/L×71%,反应物浓度为0.80mol/L×29%,由此可求出该反应的平衡常数。
③根据可逆反应的特点可知增加OH-的浓度、及时地移去产物均可以增大硝基苯甲酸乙酯的转化率。
(1) 由图可知,此反应反应物总能量高于生成物,且△H=(209-348)kJmol-1=-139kJmol-1,则热化学方程式为:N2O(g)+NO(g)=N2(g)+NO2(g) △H=-139kJ/mol,
因此,本题正确答案是:N2O(g)+NO(g)=N2(g)+NO2(g) △H=-139kJ/mol;
(2)硝酸铵分解生成N2O和H2O,达到平衡,说明为可逆反应,化学反应方程式为:NH4NO3(s)![]() N2O(g)+2H2O(g),250℃时,水为气体状态,故平衡常数K=c(N2O)×c2(H2O),NH4NO3中NH4+的N元素化合价为-3价,NO3-中的N元素的化合价为+5价,反应后N元素的化合价为+1价,发生归中反应,N元素由-3价升高为+1价,此反应中每分解1mol硝酸铵,转移电子数为4NA,
N2O(g)+2H2O(g),250℃时,水为气体状态,故平衡常数K=c(N2O)×c2(H2O),NH4NO3中NH4+的N元素化合价为-3价,NO3-中的N元素的化合价为+5价,反应后N元素的化合价为+1价,发生归中反应,N元素由-3价升高为+1价,此反应中每分解1mol硝酸铵,转移电子数为4NA,
因此,本题正确答案是:c(N2O)![]() c2(H2O);4NA;
c2(H2O);4NA;
(3) ①在60~90s内的平均反应速率![]() =
=![]() =2.35
=2.35![]() 10-3mol
10-3mol![]() L-1
L-1![]() s-1,
s-1,
在90~120s内的平均反应速率![]() =
=![]() =1.87
=1.87![]() 10-3mol
10-3mol![]() L-1
L-1![]() s-1,
s-1,
由此可得出的结论是随着反应的进行,反应物浓度减小导致反应速率降低。
②反应时间达到360s时,硝基苯甲酸乙酯的转化率不再随时间的变化而发生变化,即反应在360s时达到平衡。此时体系内两种产物浓度为0.80 mol/L×71%,反应物浓度为0.80mol/L×29%,平衡常数K=![]() =6.0,
=6.0,
③根据可逆反应的特点可知增加OH-的浓度、及时地移去产物均可以增大硝基苯甲酸乙酯的转化率。
因此,本题正确答案是:2.35![]() 10-3mol
10-3mol![]() L-1
L-1![]() s-1;1.87
s-1;1.87![]() 10-3mol
10-3mol![]() L-1
L-1![]() s-1;随着反应的进行,反应物浓度减小,反应速率减慢;6.0;增大OH-的浓度(或移去产物)。
s-1;随着反应的进行,反应物浓度减小,反应速率减慢;6.0;增大OH-的浓度(或移去产物)。


科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对3A2(g)+B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的

A. a、b、c三点平衡常数的大小关系为:Kb>Kc >Ka
B. 达到平衡时B2的转化率大小为:b>a>c
C. 增大压强有利于AB3的生成,因此在实际生产中压强越大越好
D. 若起始量为![]() ,则在T2温度下,平衡时AB3的体积分数接近b点
,则在T2温度下,平衡时AB3的体积分数接近b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在一定条件下,可与苯发生化学反应的是( )
①浓硝酸②溴水③溴的四氯化碳溶液④酸性KMnO4溶液⑤氧气
A. ①⑤B. ②④C. ②③⑤D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.

(1)指出图中明显的错误________________;________________;
(2)A仪器的名称是________________;B仪器的名称是________________;
(3)萃取、分液实验中所用主要玻璃仪器的名称是________________,静置后分液的第一步操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2在生产、生活中有着广泛的用途。
(1)请你列举一个SO2在生活中的用途:______________________。
(2)SO2在工业上常用于硫酸生产:2SO2(g)+O2(g)![]() 2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为__________________。
2SO3(g),该反应在一定条件下进行时的热效应如图所示,则其逆反应的活化能为__________________。
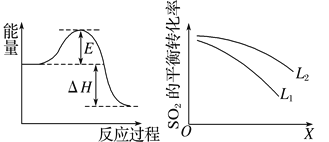
(3)上图中L、X表示物理量温度或压强,依据题中信息可判断:
①X表示的物理量是_________________________,
②L1________(填“>”“<”或“=”)L2。
(4)在容积固定的密闭容器中,起始时充入0.2molSO2和0.1molO2,反应体系起始总压强为0.1MPa。反应在一定的温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极的电极反应式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g) ![]() Fe3O4 (s)+4H2(g) ,在一个可变容积的密闭容器中进行,试回答:
Fe3O4 (s)+4H2(g) ,在一个可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率的变化是__________(填“增大”“不变”或“减小”,以下相同)。
(2)将容器的体积缩小一半,其正反应速率__________,逆反应速率__________。
(3)保持体积不变,充入N2 使体系压强增大,其正反应速率__________,逆反应速率__________。
(4)保持压强不变,充入N2使容器的体积增大,其正反应速率__________,逆反应速率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华传统文化蕴含着很多科学知识,下列说法错误的是
A. “丹砂(HgS烧之成水银,积变又还成丹砂”描述的是可逆反应
B. “水声冰下咽,沙路雪中平”未涉及化学变化
C. “霾尘积聚难见路人”形容的霾尘中有气溶胶,具有丁达尔效应
D. “含浆似注甘露钵,好与文园止消渴”说明柑橘糖浆有甜味,可以止渴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硅和氯两元素的单质反应生成1 mol Si的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69 ℃和58 ℃,写出该反应的热化学方程式__________________________________________。
(2)比较下列溶液中指定微粒浓度的大小:浓度均为0.1 mol·L-1的①H2S、②NaHS、③Na2S、④H2S和NaHS混合液,溶液pH从大到小的顺序是_____________。(填序号)c(H2S)从大到小的顺序是__________。(填序号)
(3)已知Ksp[Cu(OH)2] = 1×10-20 。要使0.2 mol / L 的CuSO4溶液中Cu2+沉淀较为完全,则应向溶液里加入NaOH溶液,调整溶液的pH范围为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com