
【题目】在密闭容器中进行如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-764.5kJ·mol-1,达到平衡后,为提高反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+2CO2(g) △H=-764.5kJ·mol-1,达到平衡后,为提高反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B.升高温度同时充入氮气
C.加催化剂同时增大压强
D.降低温度同时增大压强
科目:高中化学 来源: 题型:
【题目】强酸性溶液X中可能含有Na+ , K+、NH4+、 Fe3+、Fe2+、Al3+、CO32-、 SO32-、SO42-、C1-的若干种,某同学为了确认其成分,取X溶液进行连 续实验,实验过程及产物如下所示:
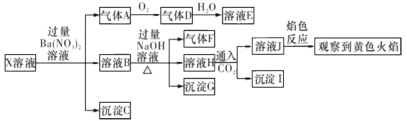
下列结论止确的是
A.气体A是SO2,证明原溶液中含有SO32-
B.沉淀G中加人盐酸溶解,滴加KSCN溶液显红色,可以确定原溶液中 有Fe3+
C.沉淀I―定是A1(OH)3
D.X中不能确定的离子是Al3+、Fe3+ 、Na+ 、K +和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.25℃,1 LpH=13的NaOH溶液中含有OH-的数目为0.1NA
B.标准状况下,4.6 g NO2和N2O4混合物中含氧原子数为0.3NA
C.标准状况下,6.72 L Cl2与水充分反应,转移电子数为0.3NA
D.0.1 mol/L NaHCO3溶液中,HCO3-、H2CO3和CO32-总数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
a | |||||||||||||||||
b | c | d | e | ||||||||||||||
f | g | ||||||||||||||||
h | |||||||||||||||||
(1)请画出上述元素h的原子结构示意图_______;元素h位于元素周期表的第_____区。
(2)e、g两种元素的气态氢化物中更稳定的是_______(写化学式);
(3)b2a2分子的电子式是________ ,该分子中存在的σ键与π键的个数比为_______。
(4)c、d两种元素中第一电离能较大的是_________(写元素符号)。
(5)f和g两种元素形成的化合物是______(填“离子化合物”“共价化合物”)。a2d分子是_________分子(填极性分子或者非极性分子)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的恒容密闭容器中发生反应A(g)+2B(g)![]() 3C(g)。反应过程中的部分数据如下表所示:
3C(g)。反应过程中的部分数据如下表所示:
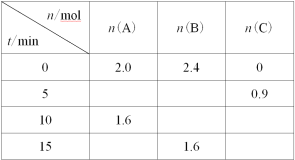
下列说法正确的是( )
A.0~5min用A表示的平均反应速率为0.09mol·L1·min1
B.该反应在10min后才达到平衡
C.平衡状态时,c(C)=0.6mol·L1
D.物质B的平衡转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)在皮革、火柴、印染化学、电镀等方面应用广泛。回答下列问题:
(1)酒驾醉驾危害社会安全,早期测定是否饮酒的方法是重铬酸钾法:溶液由橙红色变为绿色(Cr3+)则表明已经饮酒。写出重铬酸钾法检验饮酒的离子方程式:___________________________。
(2)用铬铁矿(FeOCr2O3,含Al2O3杂质)为原料制备重铬酸钾的工艺:
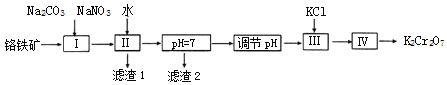
已知:i. 2CrO42﹣+2H+ ![]() Cr2O72﹣+H2O;
Cr2O72﹣+H2O;
ii.常温,Ksp[Al(OH)3]=1.3×10﹣33;
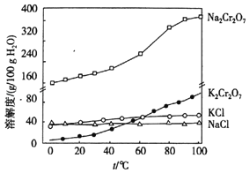
iii.有关物质的溶解度曲线如图:
①上述工艺流程图中的操作I的主要反应为:2FeOCr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,另外一个反应的化学方程式是__________。
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,另外一个反应的化学方程式是__________。
②滤渣2的成分是_____(写化学式),常温,滤液中,c(Al3+)=_____molL﹣1
③工艺流程图中,操作“调节pH”的作用是_________________________________。
④操作Ⅲ,加入KCl的目的是________________________________________;实验室中,操作IV用到的玻璃仪器有酒精灯、烧杯、___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)降低温度,化学反应速率___(填“增大”“减小”或“不变”)。
(2)600℃时,在一容积为2L的密闭容器中,将二氧化硫和氧气混合,在反应进行至10min和20min时,分别改变了影响反应的一个条件,反应过程中SO2、O2、SO3物质的量变化如图所示,反应前15min用SO3表示的平均反应速率为___。
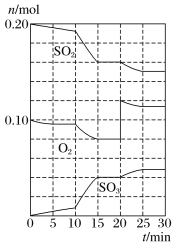
(3)已知0-15min反应放出的总热量为QkJ,写出该反应的热化学方程式____。
(4)根据如图判断,10min时改变的反应条件可能是___(填编号,下同);20min时改变的反应条件可能是____。
a.加入催化剂 b.缩小容器容积
c.降低温度 d.增加O2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以利用镁粉在加热条件下与氮气反应制备氮化镁。用一瓶氮气样品(含少量CO2、CO、O2)制备氮化镁。已知:连苯三酚碱性溶液定量吸收O2;CuCl的盐酸溶液能定量吸收CO且易被O2氧化。
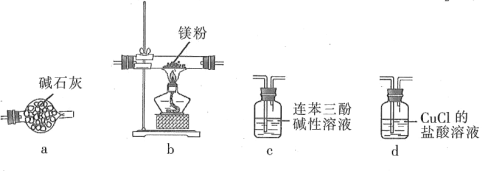
下列说法正确的是
A.装置连接顺序:氮气样品→d→c→a→b
B.装置a可以用盛装浓硫酸的洗气瓶替代
C.若先点燃酒精灯后通气体,产品纯度降低
D.d装置中的CuCl在除杂中表现还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2012年2月,江苏镇江自来水出现异味,引发镇江及位于其下游的南通等地区发生居民抢购瓶装饮用水的现象。经初步调查,韩国籍船舶“格洛里亚”号货轮水下排放管道排出的苯酚是引起自来水异味的主要原因。请完成以下填空:
(1)苯酚与水混合,溶液变浑浊,向该浑浊液中滴加NaOH溶液,可观察到的现象是____,向上述反应液中继续通入过量CO2,又可观察到的现象是____,则通入CO2时的反应为_____,说明苯酚具有_______性。
(2)A和B两种物质的分子式都是C7H8O,它们都能跟金属钠反应放出氢气。B能使适量溴水褪色,并产生白色沉淀,A不能。B苯环上的一溴代物有两种。
①写出A和B的结构简式:A________,B_______________。
②写出B与NaOH溶液反应的化学方程式:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com