
| A、此时水的离子积KW=1.0×10-14 |
| B、水电离出的c(H+)=1.0×10-10mol/L |
| C、水的电离度程不随温度升高而变化 |
| D、100℃时,蒸馏水呈酸性 |
| 1×10-12 |
| 0.01 |


科目:高中化学 来源: 题型:
| A、x值是2 |
| B、P平衡转化率为66.7% |
| C、平衡常数为1 |
| D、反应前,Q的物质的量为3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu、Cu、稀硫酸 |
| B、Zn、Cu、氯化钠溶液 |
| C、Cu、Zn、酒精 |
| D、Zn、Cu、CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20g | B、50g/mol |
| C、50 | D、60g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H6 |
| B、C3H4 |
| C、C3H8 |
| D、C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用苯萃取碘水中的碘时,应先打开上端玻璃塞再将苯层从分液漏斗下口放出 |
| B、用湿润的红色石蕊试纸检验氨气 |
| C、稀释浓硫酸时,应将浓硫酸沿玻璃棒缓慢注入盛水的量筒中 |
| D、用广泛pH试纸测得0.1 mol?L-1NH4Cl溶液的pH=5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
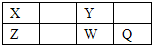 短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法不正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法不正确的是( )| A、钠与W可能形成Na2W2化合物 |
| B、由X与Q两种元素组成的物质在熔融时不能导电 |
| C、X和Z的单质均有原子晶体 |
| D、X有多种同素异形体,而Y不存在同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X原子、Y原子分别形成离子时,X原子得到电子数目比Y原子多 |
| B、X单质能与Y的气态氢化物反应生成Y的单质 |
| C、两元素的气态氢化物分别溶水后,溶液的酸性X比Y强 |
| D、X元素的最高正化合价高于Y元素的最高正化合价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g氮气所含有的原子数目为NA |
| B、标准状况下,22.4LH2O含有的分子数为 NA |
| C、NA 个CO2分子占有的体积一定为22.4L |
| D、标准状况下,22.4L H2和O2混合气所含的分子数一定等于NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com