B
分析:A.气体摩尔体积22.4L/mol必须适用于标况下的气体物质,苯在标准状况下不是气体;
B.1个氧气分子中含有2个原子,根据质量和微粒数目之间的关系式:N=n×N
A=

N
A,进行解答;
C.1mol氨气中含有3mol氮氢共价键;
D.依据电解精炼铜的原理和电极反应分析计算.
解答:A.标准状况下,苯呈液态,故22.4L的苯并不是1mol,故A错误;
B.1个氧气分子中含有2个原子,常温下,在18g
18O
2中含有的氧原子为N=2n×N
A=

×2N
A=
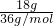
×2N
A=N
A,故B正确;
C.根据公式17g NH
3的物质的量为n=

=
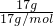
=1mol,1mol氨气中含有3mol氮氢共价键,所以标准状况下,17g NH
3所含共价键数为3N
A个,故C错误;
D.电解精炼铜时阳极电极反应Cu-2e
-=Cu
2+,Fe-2e-=Fe
2+,Zn-2e-=Zn
2+,Ni-2e-=Ni
2+,阴极电极反应为Cu
2++2e
-=Cu,若阴极得到电子数为2N
A个,依据电子守恒,阳极失去的电子物质的量为2mol,为几种金属共失去的电子,不是铜失电子物质的量,固体质量减少不是64g,故D错误;
故选B.
点评:本题主要考查了阿伏伽德罗常数的应用,关键答题时正确计算微粒的物质的量,仔细分析微粒间的数量关系,题目难度不大.

 NA,进行解答;
NA,进行解答; ×2NA=
×2NA=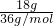 ×2NA=NA,故B正确;
×2NA=NA,故B正确; =
=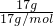 =1mol,1mol氨气中含有3mol氮氢共价键,所以标准状况下,17g NH3所含共价键数为3NA个,故C错误;
=1mol,1mol氨气中含有3mol氮氢共价键,所以标准状况下,17g NH3所含共价键数为3NA个,故C错误;
