
����Ŀ����1�������Ȼ�����Һ�ش��������⣺
����FeCl3��Һ�м�������NaHCO3������������Ϊ___�������ӷ���ʽ��ʾ��ԭ��___��
�ڲ��ϼ���FeCl3��Һ������ˮ�ֲ����գ��õ��Ĺ�����___��
��������FeCl3��Һʱ��Ϊ��ֹ��Һ����ǣ�Ӧ����___��
��2�����÷�ӦCu+H2O2+H2SO4=CuSO4+2H2O���һ��ԭ��أ��ش��������⣺
�ٸ�������Ϊ___��������ӦʽΪ___��
�ڷ�Ӧ������SO![]() ��____���ƶ���
��____���ƶ���
�۵���·��ת��0.1mol����ʱ�����Һ����(�����缫)������___�ˡ�
��3����֪25��ʱ����������ʵĵ���ƽ�ⳣ�����������ʾ���ش��������⣺
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | Ka=1.8��10-5 | Ka1=4.3��10-7 Ka2=5.6��10-11 | Ka=3.0��10-8 |
�����ʵ���Ũ�Ⱦ�Ϊ0.1molL-1��������Һ��pH��С�������е�˳����__���ñ����д��
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
�ڳ����£�0.1molL-1CH3COOH��Һ��ˮϡ�����У����б���ʽ�����ݱ�����___������ĸ��
A.c��H+�� B.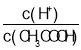 C.c��H+��c��OH-�� D.
C.c��H+��c��OH-�� D.![]() E.
E.![]()
��д�������������Һ��ͨ������������̼�����ӷ���ʽ��____��
��25��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH=6������Һ��c��CH3COO-��-c��Na+��=____����ȷ��ֵ����
�ݱ�״���£���1.12LCO2ͨ��100mL1molL-1��NaOH��Һ�У�����Һ������Ũ�ȷ���������е�ʽ��c��OH-��=2c��H2CO3��+____��
���𰸡�������ͺ��ɫ�������� Fe3++3HCO![]() =3CO2��+Fe(OH)3�� Fe2O3 Ũ���� Cu H2O2+2H++2e-=2H2O �� 3.2 a��d��c��b BD ClO-��H2O��CO2=HCO
=3CO2��+Fe(OH)3�� Fe2O3 Ũ���� Cu H2O2+2H++2e-=2H2O �� 3.2 a��d��c��b BD ClO-��H2O��CO2=HCO![]() ��HClO 9.9��10-7molL-1 c��HCO
��HClO 9.9��10-7molL-1 c��HCO![]() ��+c��H+��
��+c��H+��
��������
��1������FeCl3��Һ�м�������NaHCO3������˫ˮ�⣬�������������Ͷ�����̼���壬����������Ϊ������ͺ��ɫ���������������ӷ���ʽ��ʾ��ԭ��Fe3++3HCO![]() =3CO2��+Fe(OH)3�����ʴ�Ϊ��������ͺ��ɫ����������Fe3++3HCO
=3CO2��+Fe(OH)3�����ʴ�Ϊ��������ͺ��ɫ����������Fe3++3HCO![]() =3CO2��+Fe(OH)3����
=3CO2��+Fe(OH)3����
�ڲ��ϼ���FeCl3��Һ������ˮ�ֲ����գ���������FeCl3��Һʱ��FeCl3ˮ����������������HCl�����ȴٽ�HCl�ӷ����Ӷ��ٽ�FeCl3ˮ�⣬����ʱ�õ������������壬���������������壬���������ֽ�������������ˮ���õ��Ĺ�����Fe2O3���ʴ�Ϊ��Fe2O3��
��FeCl3ˮ����������������HCl��Ϊ�����Ȼ���ˮ�⣬����Һ�еμ�Ũ���ἴ�ɡ��ʴ�Ϊ��Ũ���
��2�����÷�ӦCu+H2O2+H2SO4=CuSO4+2H2O���һ��ԭ��أ��ٸ÷�Ӧ��CuԪ�ػ��ϼ���0�۱�Ϊ+2�ۡ�OԪ�ػ��ϼ���-1�۱�Ϊ-2�ۣ�Ҫ���÷�Ӧ��Ƴ�ԭ��أ�Cu��������������H2O2�õ��ӷ�����ԭ��Ӧ����Ϊ�����������£�����H2O2�õ��Ӻ������ӷ�Ӧ����ˮ���缫��ӦʽΪH2O2+2H++2e-=2H2O��������������ΪCu��������ӦʽΪH2O2+2H++2e-=2H2O���ʴ�Ϊ��Cu��H2O2+2H++2e-=2H2O��
��ԭ����У����������ƶ�����Ӧ������SO![]() ���ƶ����ʴ�Ϊ������
���ƶ����ʴ�Ϊ������
�۵���·��ת��0.1mol����ʱ������Cu��2e��=Cu2��������0.05molCu2�������Һ����(�����缫)������0.05mol��64g��mol��1=3.2�ˡ��ʴ�Ϊ��3.2��
��3����Na2CO3��ǿ�������Σ�̼�������ˮ�����Һ�ʼ��ԣ�NaClO��ǿ��������ˮ���Լ��ԣ�CH3COONa��ǿ�������Σ����������ˮ�����Һ�ʼ��ԣ�NaHCO3��ǿ�������Σ�ˮ���Լ��ԣ�������CH3COOH>H2CO3>HClO>HCO![]() �����������Խ���������ˮ������Խǿ����ˮ��������CH3COO��<HCO
�����������Խ���������ˮ������Խǿ����ˮ��������CH3COO��<HCO![]() <ClO��<CO
<ClO��<CO![]() ������Һ�ļ���Na2CO3>NaClO>NaHCO3>CH3COONa����pH��a��d��c��b���ʴ�Ϊ��a��d��c��b��
������Һ�ļ���Na2CO3>NaClO>NaHCO3>CH3COONa����pH��a��d��c��b���ʴ�Ϊ��a��d��c��b��
��A��CH3COOH��Һ��ˮϡ���̣���ٽ����룬��c��H������С����A��ѡ��
B��![]() ��CH3COOH��Һ��ˮϡ���̣��ٽ����룬���������ʵ������������ʵ�����С����ϡ�����б�ֵ���Bѡ��
��CH3COOH��Һ��ˮϡ���̣��ٽ����룬���������ʵ������������ʵ�����С����ϡ�����б�ֵ���Bѡ��
C��ϡ���̣�c��H������С��c��OH��������c��H������c��OH����=Kw��Kwֻ���¶�Ӱ�����Բ��䣬��C��ѡ��
D��ϡ���̣�c��H������С��c��OH����������![]() ���Dѡ��
���Dѡ��
E.![]() �Ǵ���ĵ��볣����ֻ���¶��йأ��¶Ȳ��䣬
�Ǵ���ĵ��볣����ֻ���¶��йأ��¶Ȳ��䣬![]() ���䣬��E��ѡ��
���䣬��E��ѡ��
�ʴ�Ϊ��BD��
������H2CO3>HClO>HCO3���������������Һ��ͨ������������̼����̼�����ƺʹ����ᣬ���ӷ���ʽ��ClO-��H2O��CO2=HCO![]() ��HClO���ʴ�Ϊ��ClO-��H2O��CO2=HCO
��HClO���ʴ�Ϊ��ClO-��H2O��CO2=HCO![]() ��HClO��
��HClO��
��25��ʱ��CH3COOH��CH3COONa�Ļ����Һ�����ڵ���غ㣺c��Na����+c��H����=c��OH����+c��CH3COO����������û��ҺpH=6������Һ��c��CH3COO-��-c��Na+��=c��H����-c��OH����=10-6mol��L��1-10-8mol��L��1=9.9��10-7mol��L��1���ʴ�Ϊ��9.9��10-7molL-1��
�ݱ�״���£�1.12L CO2�����ʵ���Ϊ��![]() =0.05mol���������Ƶ����ʵ���Ϊ��1mol��L-1��0.1L=0.1mol������ǡ����ȫ��Ӧ����̼���ƣ�����̼������Һ�е������غ�ɵã�c��OH-��=2c��H2CO3��+c��HCO
=0.05mol���������Ƶ����ʵ���Ϊ��1mol��L-1��0.1L=0.1mol������ǡ����ȫ��Ӧ����̼���ƣ�����̼������Һ�е������غ�ɵã�c��OH-��=2c��H2CO3��+c��HCO![]() ��+c��H+�����ʴ�Ϊ��c��HCO
��+c��H+�����ʴ�Ϊ��c��HCO![]() ��+c��H+����
��+c��H+����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017��5��18���й����ʵ�����������ҹ����Ϻ����еĿ�ȼ���Բɻ�óɹ�����Ϊȫ���һ����ÿ�ȼ�������ȶ������Ĺ��ҡ���ȼ������Ȼ����ˮ������γɵľ������ʣ���Ҫ�����ڶ�����ͺ��״�½���С�����˵����ȷ����( )

�ټ����������ࣻ����ͬ�����£�������ܶȴ��ڿ������ܶȣ��ۼ���������ˮ���ܿ�ȼ����һ�ּ���DZ������Դ������ظ�ԭ���ܴ��ھ����������ȼ����
A.�٢ۢܢ�B.�ڢۢܢ�C.�٢ڢۢ�D.�٢ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����յ���һ�š����ṹ����ͼ��ʾ����һ�ֺϳ�Ⱦ�ϣ���ѧ��ͨ��������ѧ�о������ֳ���ʳ�ú����յ����ʳƷ������������°����ء����й��ڡ��յ���һ�š���˵��������ȷ����

A. ���ڷ����廯�������ʽΪC16H12N2O
B. �����е�����ԭ�ӿ���λ��ͬһƽ����
C. �����б����ϵ�һȡ���ﹲ��11��
D. ����NaOH��Һ��FeCl3��Һ����ˮ�����ʷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ڹ�ũҵ���������Ź㷺Ӧ�ã��ش��������⣺
![]() ��̬��ԭ�ӵļ۵����Ų�ʽΪ_________��Ԫ�����ĵڶ������ܱ�ͭ��С����ԭ��Ϊ_________________��
��̬��ԭ�ӵļ۵����Ų�ʽΪ_________��Ԫ�����ĵڶ������ܱ�ͭ��С����ԭ��Ϊ_________________��
![]() �ļ����ͨ�����·�Ӧ���У�
�ļ����ͨ�����·�Ӧ���У�
![]() �������̼ԭ�ӵ��ӻ��������Ϊ___________��
�������̼ԭ�ӵ��ӻ��������Ϊ___________��
![]() ������뿺���
������뿺���![]() ��
��![]() �д��ڵ���������_________
�д��ڵ���������_________![]() ��ѡ����ĸ
��ѡ����ĸ![]() ��
��
A.![]() ��
�� ![]() ��
�� ![]() ���
��� ![]() ���
���
![]() ���ʻ���
���ʻ���![]() Ϊ��ɫ�ӷ��Ծ綾Һ�塣�۵�
Ϊ��ɫ�ӷ��Ծ綾Һ�塣�۵�![]() ���е�
���е�![]() ��������ˮ���������Ҵ����л��ܼ����������幹�͡����ʻ����ľ���������__________��
��������ˮ���������Ҵ����л��ܼ����������幹�͡����ʻ����ľ���������__________��![]() ��ͨ�����·�Ӧ�ϳɣ�
��ͨ�����·�Ӧ�ϳɣ�![]() ����Ӧ���漰����Ԫ�صĵ縺���ɴ�С��˳��Ϊ______________����
����Ӧ���漰����Ԫ�صĵ縺���ɴ�С��˳��Ϊ______________����![]() ��Ϊ�ȵ�����ķ�����__________
��Ϊ�ȵ�����ķ�����__________![]() ��д1��
��д1��![]() ��
��
![]() ��La�ĺϽ���Ŀǰʹ�ù㷺�Ĵ�����ϣ����д����������������͵��µ��ص㣬���й���ʵ���˲�ҵ�����úϽ�ľ����ṹ��ͼ��ʾ��
��La�ĺϽ���Ŀǰʹ�ù㷺�Ĵ�����ϣ����д����������������͵��µ��ص㣬���й���ʵ���˲�ҵ�����úϽ�ľ����ṹ��ͼ��ʾ��
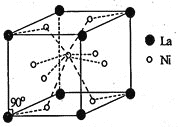
![]() �þ���Ļ�ѧʽΪ____________��
�þ���Ļ�ѧʽΪ____________��
![]() ��֪�þ����Ħ������Ϊ
��֪�þ����Ħ������Ϊ![]() ���ܶ�Ϊ
���ܶ�Ϊ![]() ����
����![]() Ϊ�����ӵ�������ֵ����þ����������___________
Ϊ�����ӵ�������ֵ����þ����������___________![]() �ú�M��d��
�ú�M��d��![]() �Ĵ���ʽ��ʾ
�Ĵ���ʽ��ʾ![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��� 0.1 mol��L-1 KOH ��Һ�ζ� 10 mL 0.1 mol��L-1 HA��Ka ��1.0��10-5����Һ�ĵζ�������ͼ��ʾ������˵����ȷ���ǣ� ��
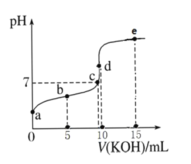
A.a ����Һ�� pH ԼΪ 5
B.ˮ�ĵ���̶ȣ�c �㣾d ��
C.b ����Һ������Ũ�ȴ�С�� c(A-)��c(K+)��c(HA)��c(H+)��c(OH-)
D.e ����Һ�У�c(K+)=2c(A-)+2c(HA)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС���ÿ��϶�����(Kjeldahl method)���ⶨũ��Ʒ�е��ĺ������ⶨ��������:
I.����Ũ���ᴦ��0.25g������Ʒ�����л���ת��Ϊ��Ρ�
II.����ͼ��ʾװ�ô����������(�г�װ����ȥ)��
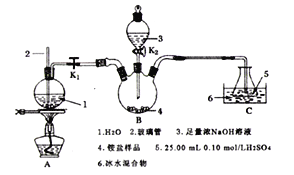
�ش���������:
(1)ʵ��ǰҪ����Bװ�õ������ԣ��������Ϊ______________________________��
(2)ʢ������������Һ����������Ϊ__________________��������2��������___________________��Բ����ƿ�����Ƭ��������_________________________________________��
(3)�������ﴦ�������õ���Ρ���������ƿ�У�������������K2��������������������Һ���ر�K2����K1����ȼ�ƾ���ʹˮ��������Bװ�á�
��Bװ���з�Ӧ�����ӷ���ʽΪ_______________________________��
��Cװ�ñ�ˮ������������__________________________________��
III.�ζ������㵪�ĺ���
(4)ȡ����ƿ������ָʾ������0.10mol/L��NaOH��Һ�ζ����ظ��ζ�3�Σ�ƽ������19.30mLNaOH��Һ��
�ٸõζ���ָʾ��Ӧѡ��____________________��
a.���� b.��̪ c.���Ȼ��̪
�ڸù�����Ʒ�е��İٷֺ���Ϊ_____________��(����2λС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Ľṹ��ʽΪ �мס��ҡ��������ĸ�ͬѧ������������Ϊ��2��2-����-4-�һ����飻3��5��5-�������飻4��4-����-2-�һ����飻2��2��4-�������顣���ж���λͬѧ�������ж�����ȷ���� (����)
�мס��ҡ��������ĸ�ͬѧ������������Ϊ��2��2-����-4-�һ����飻3��5��5-�������飻4��4-����-2-�һ����飻2��2��4-�������顣���ж���λͬѧ�������ж�����ȷ���� (����)
A.����������ѡ������ȷ��B.�ҵ���������Ǵ����
C.������������ѡ������ȷ��D.���������Ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ۼ���ij��Һ�У��������ų��������Һ��һ���ܹ������������������:( )
A.K+��Na+��![]() ��Cl-B.
��Cl-B.![]() ��Al3+��Cl-��
��Al3+��Cl-��![]()
C.K+��Na+��[Al(OH)4]-��![]() -D.Na+��K+��
-D.Na+��K+��![]() ��Br-
��Br-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л�����ת����ϵ��ͼ��ʾ(���±仯�У�ijЩ��Ӧ����������δ����)��A����Ȼ�л��߷��ӻ����D��һ����Ҫ�Ļ���ԭ�ϡ�����ͬ�����£�G�����ܶ���������44����
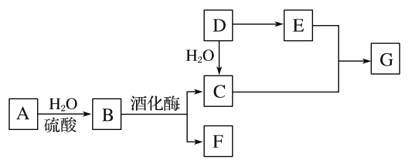
(1)D�й����ŵ����ƣ�______________________________________��
(2)C��E��Ӧ�Ļ�ѧ����ʽ��________________________��
(3)����Aת����������B���ɣ����к�ˮ��Һ������Ҫ������Լ���________________________________��
(4)ij��X����Է���������D��F֮�ͣ�������̼���������֮����5��1������˵����ȷ����________(����ĸ)��
A��X ������ˮ������黥Ϊͬϵ��
B��X�����ȶ��������²���ֽ�
C��X�����ں���3������ͬ���칹��
D��X���ܺ���ˮ�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com