
【题目】常见有机物间的转化关系如图所示(以下变化中,某些反应条件及产物未标明)。A是天然有机高分子化合物,D是一种重要的化工原料。在相同条件下,G蒸气密度是氢气的44倍。
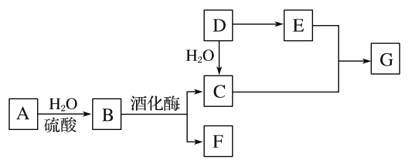
(1)D中官能团的名称:______________________________________。
(2)C和E反应的化学方程式:________________________。
(3)检验A转化过程中有B生成,先中和水解液,再需要加入的试剂是________________________________。
(4)某烃X的相对分子质量是D、F之和,分子中碳与氢的质量之比是5∶1。下列说法正确的是________(填字母)。
A.X 不溶于水,与甲烷互为同系物
B.X性质稳定,高温下不会分解
C.X不存在含有3个甲基的同分异构体
D.X可能和溴水发生加成反应
【答案】 碳碳双键 CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O 新制氢氧化铜(或银氨溶液) A
CH3COOCH2CH3+H2O 新制氢氧化铜(或银氨溶液) A
【解析】A是天然有机高分子化合物,在酸性条件下水解得B,B在酒化酶的作用下生成C和F,所以A为(C6H10O5)n,B为C6H12O6,G蒸气密度是氢气的44倍,即G的相对分子质量为88,D是一种重要的化工原料,D与水加成得C,所以C为CH3CH2OH,F为CO2,则D为CH2=CH2,D氧化得E为CH3COOH,C和E发生酯化反应生成G为CH3COOCH2CH3,烃X的相对分子质量是D、F之和,即为72,分子中碳与氢的质量之比是5:1,则X为C5H12;
(1)根据上面的分析可知,D为CH2=CH2,D中官能团的名称为碳碳双键;(2)C和E发生酯化反应生成CH3COOCH2CH3,反应的化学方程式CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O;(3)检验A转化过程中有B生成,即检验葡萄糖的存在,先中和水解液,需要再加入的试剂是新制氢氧化铜(或银氨溶液);(4)X为C5H12,是饱和烷烃;A.C5H12不溶于水,与甲烷互为同系物,A正确;B.C5H12在高温下会分解,B错误;C.C5H12的一种同分异构体为2,2-二甲基丙烷,有四个甲基,C错误;D.烷烃和溴水不发生加成反应,D错误;答案选A。
CH3COOCH2CH3+H2O;(3)检验A转化过程中有B生成,即检验葡萄糖的存在,先中和水解液,需要再加入的试剂是新制氢氧化铜(或银氨溶液);(4)X为C5H12,是饱和烷烃;A.C5H12不溶于水,与甲烷互为同系物,A正确;B.C5H12在高温下会分解,B错误;C.C5H12的一种同分异构体为2,2-二甲基丙烷,有四个甲基,C错误;D.烷烃和溴水不发生加成反应,D错误;答案选A。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】(1)根据氯化铁溶液回答下列问题:
①向FeCl3溶液中加入少量NaHCO3。产生的现象为___。用离子方程式表示其原因___。
②不断加热FeCl3溶液蒸干其水分并灼烧,得到的固体是___。
③在配制FeCl3溶液时,为防止溶液变浑浊,应加入___。
(2)利用反应Cu+H2O2+H2SO4=CuSO4+2H2O设计一个原电池,回答下列问题:
①负极材料为___;正极反应式为___。
②反应过程中SO![]() 向____极移动。
向____极移动。
③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了___克。
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
①物质的量浓度均为0.1molL-1的四种溶液:pH由小到大排列的顺序是__(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②常温下,0.1molL-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是___(填字母)
A.c(H+) B.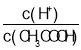 C.c(H+)c(OH-) D.
C.c(H+)c(OH-) D.![]() E.
E.![]()
③写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:____。
④25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=____(填准确数值)。
⑤标准状况下,将1.12LCO2通入100mL1molL-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 微溶于水,可溶于硝酸。溶液X中可能含有
微溶于水,可溶于硝酸。溶液X中可能含有![]() 中的几种离子。为了确定其组成,某同学进行了如下实验:
中的几种离子。为了确定其组成,某同学进行了如下实验:
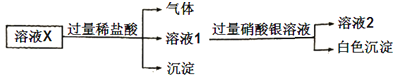
下列说法正确的是( )
A.溶液X中一定含有![]()
![]() 和
和![]()
B.溶液X中一定不含![]() 、
、![]()
C.为确定溶液X中是否含有![]() ,可取溶液2,加入
,可取溶液2,加入![]() 溶液
溶液
D.在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变为红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫代硫酸钠在酸性条件下会发生反应:![]() ,下表中的两种溶液混合,出现浑浊的先后顺序是( )
,下表中的两种溶液混合,出现浑浊的先后顺序是( )
组号 | 两种溶液的温度 |
| 稀硫酸的体积、浓度 |
① | 15℃ | 10mL0.1mol/L | 50mL0.05mol/L |
② | 15℃ | 10mL0.05mol/L | 10mL0.1mol/L |
③ | 25℃ | 10mL0.05mol/L | 10mL0.1mol/L |
④ | 25℃ | 10mL0.1mol/L | 30mL0.07mol/L |
A.④①②③B.③④②①
C.④③②①D.④③①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3的混合物中加入120 mL 4 mol/L的稀硝酸,恰好使混合物完全溶解, 放出1. 344 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的CO在加热下还原相同质量的混合物,能得到铁的物质的量为( )
A.0. 24 molB.0. 21 molC.0. 16 molD.0. 14 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g) ![]() 2Z(g),此反应达到平衡状态的标志是( )
2Z(g),此反应达到平衡状态的标志是( )
A. 容器内气体密度不随时间变化 B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2 D. 单位时间内消耗0.1 mol X,同时生成0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有M、N、P、E、F五种金属,已知:①![]() ;②M、P用导线连接并放入硫酸氢钠溶液中,M表面有大量气泡逸出;③N、E用导线连接并放入E的硫酸盐溶液中,其中一极的电极反应式为
;②M、P用导线连接并放入硫酸氢钠溶液中,M表面有大量气泡逸出;③N、E用导线连接并放入E的硫酸盐溶液中,其中一极的电极反应式为![]() ;④P、F组成原电池时,F发生氧化反应。则这五种金属的还原性顺序是( )
;④P、F组成原电池时,F发生氧化反应。则这五种金属的还原性顺序是( )
A.F>P>M>N>EB.E>N>M>P>F
C.P>F>N>M>ED.E>P>F>M>N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素含量居金属首位, 主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ、工业上用铝土矿制备铝的某种化合物的工艺流程如下:
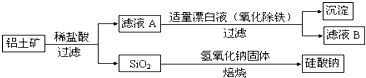
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
Fe2++□ClO-+□ ═□Fe(OH)3↓+□Cl-+□__________
②检验滤液B中是否还含有铁元素的方法为:_________________________
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、__________(填操作名称)、过滤、洗涤。
Ⅱ、明矾(KAl(SO4)2·12H2O)在日常生活、生产中也占有一席之地。
(1)明矾曾经是净水明星,用离子方程式表示其净水原理_____________________________。
(2)明矾净水时,若不慎过量会有一定程度的副作用。将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,并且过滤,就可以避免,请用离子反方程式描述其过程______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积均为1 L的三个密闭容器中,分别放入铁粉并充入1 mol CO,控制在不同温度下发生反应:Fe(s)+5CO(g)![]() Fe(CO)5(g),当反应进行到5 min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的( )
Fe(CO)5(g),当反应进行到5 min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的( )
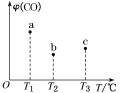
A.反应进行到5 min时,b容器中v(正)=v(逆)
B.正反应为吸热反应
C.b中v(正)大于a中v(逆)
D.达到平衡时,a、b、c中CO的转化率为b>c>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com