
【题目】铝元素含量居金属首位, 主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ、工业上用铝土矿制备铝的某种化合物的工艺流程如下:
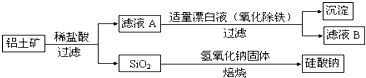
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
Fe2++□ClO-+□ ═□Fe(OH)3↓+□Cl-+□__________
②检验滤液B中是否还含有铁元素的方法为:_________________________
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、__________(填操作名称)、过滤、洗涤。
Ⅱ、明矾(KAl(SO4)2·12H2O)在日常生活、生产中也占有一席之地。
(1)明矾曾经是净水明星,用离子方程式表示其净水原理_____________________________。
(2)明矾净水时,若不慎过量会有一定程度的副作用。将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,并且过滤,就可以避免,请用离子反方程式描述其过程______________。
【答案】 2Fe2++1ClO-+5H2O=2Fe(OH)3↓+1C1-+4H+ 取少量滤液B,加入KSCN溶液,若不变红,说明滤液B中不含铁元素;若变红,说明滤液B中含铁元素(其他合理答案均得分) c 冷却结晶 Al3++3H2O ![]() Al(OH)3(胶体)+3H+ 2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓
Al(OH)3(胶体)+3H+ 2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓
【解析】(1). ①滤液A中含有氯化铁和氯化亚铁、氯化铝,加入漂白液,目的是氧化除铁,所得滤液B显酸性,说明生成了氢离子,次氯酸根离子具有氧化性氧化亚铁离子生成铁离子,在溶液中形成氢氧化铁沉淀除去,次氯酸根离子被还原为氯离子,根据电子守恒和电荷守恒分析,所以反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+,故答案为: 2Fe2++1ClO-+5H2O=2Fe(OH)3↓+1C1-+4H+ ; ②滤液B中是否含有铁元素的方法为利用铁离子的检验方法进行,铁离子遇到硫氰化钾显红色,所以答案为: 取少量滤液B,加入KSCN溶液,若不变红,说明滤液B中不含铁元素;若变红,说明滤液B中含铁元素(其他合理答案均得分);③ 滤液B 中铝元素以铝离子形式存在,将其转化为沉淀需要加入氨水,加入氢氧化钠不好控制其物质的量多少,因为氢氧化铝可以溶于氢氧化钠,故答案为:c; ④滤液B制备氯化铝晶体涉及的的方法为重结晶,将溶液加热浓缩,然后冷却结晶,过滤、洗涤、干燥即可得氯化铝晶体,故答案为:冷却结晶;Ⅱ、 (1) 明矾净水是明矾中的铝离子水解生成氢氧化铝胶体具有吸附作用,故答案为:Al3++3H2O ![]() Al(OH)3(胶体)+3H+ ;(2)将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,则2摩尔明矾需要6摩尔氢氧化钡,离子方程式为:2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓。故答案为:2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓。
Al(OH)3(胶体)+3H+ ;(2)将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,则2摩尔明矾需要6摩尔氢氧化钡,离子方程式为:2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓。故答案为:2Al3++3SO42-+3Ba2++6OH-==2Al(OH) 3↓+3BaSO4↓。


科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.NH3具有还原性,可用作制冷剂B.SO2具有氧化性,可用于漂白纸张
C.FeCl3溶液具有酸性,可用于蚀刻铜制品D.Al(OH)3具有弱碱性,可用作胃酸中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量的Cu,Cu2O,CuO的固体混合物,将其分成两等份.其中一份通入足量的氢气充分反应后固体质量为25.6g,另一份加入500mL稀硝酸中固体恰好完全溶解并产生标准状况下的NO气体4.48L.已知Cu2O+2H+═Cu+Cu2++H2O.则稀硝酸的浓度为( )
A.2 molL﹣1
B.1.6 molL﹣1
C.0.8 molL﹣1
D.0.4 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混和酸,加入反应器中.
②向室温下的混和酸中逐滴加入一定量的苯,充分振荡,混和均匀.
③在50-60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤.
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯.
填写下列空白:
(1)配制一定比例浓硫酸与浓硝酸混和酸时,操作注意事项是__________________________;
(2)步骤③中,为了使反应在50-60℃下进行,常用的方法是__________________________;
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是__________________________;
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是__________________________;
(5)写出该反应的方程式____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.同一原子中,内层电子激发到外层电子需要放出能量
B.某原子的质子数为118,在周期表中位于第七周期零族
C.同一周期中,随着核电荷数的增加,元素的非金属性一定增大
D.同一主族中,不同元素的原子序数相差不可能为10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氢键具有方向性和饱和性
B.分子内键能越小,表示该分子受热越难分解
C.在分子中,两个成键的原子间的距离叫键长
D.对于由分子构成的物质,相对分子质量越大,其熔沸点一定越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有关杂化轨道的说法中正确的是( )
A.sp3 杂化轨道中轨道数为 4,且 4 个杂化轨道能量相同
B.杂化轨道既可能形成σ键,也可能形成π键
C.杂化轨道不能容纳孤电子对
D.sp2杂化轨道最多可形成 2 个σ键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com