
【题目】向一定量的Fe、FeO、Fe2O3的混合物中加入120 mL 4 mol/L的稀硝酸,恰好使混合物完全溶解, 放出1. 344 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的CO在加热下还原相同质量的混合物,能得到铁的物质的量为( )
A.0. 24 molB.0. 21 molC.0. 16 molD.0. 14 mol
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1 mol·L-1 KOH 溶液滴定 10 mL 0.1 mol·L-1 HA(Ka =1.0×10-5)溶液的滴定曲线如图所示。下列说法正确的是( )
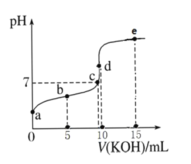
A.a 点溶液的 pH 约为 5
B.水的电离程度:c 点>d 点
C.b 点溶液中粒子浓度大小: c(A-)>c(K+)>c(HA)>c(H+)>c(OH-)
D.e 点溶液中:c(K+)=2c(A-)+2c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.制取Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.锅炉除水垢时先用纯碱浸泡:CaSO4+CO32-=CaCO3+SO42-
C.泡沫灭火器灭火原理:2Al3++3CO32-+3H2O =2Al(OH)3↓+3CO2↑
D.碳酸钠溶液显碱性:CO32-+2H2OH2CO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾纯品为暗紫色有光泽粉末。在198 ![]() 以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为K2FeO4,工业制备高铁酸钾的离子方程式为
以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为K2FeO4,工业制备高铁酸钾的离子方程式为![]() (未配平),下列有关说法不正确的是( )
(未配平),下列有关说法不正确的是( )
A.由上述反应可知,Fe(OH)3的氧化性强于![]()
B.高铁酸钾中铁显 + 6价
C.上述反应氧化剂和还原剂的物质的量之比为3 : 2
D.K2FeO4处理水时,不仅能消毒杀菌,而且生成Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.CH3(C2H5)CHCH(CH3)2的系统命名为2—甲基—3—乙基丁烷
B.苯甲酸的结构简式为![]()
C.C5H10的同分异构体中属于烯烃的有6种(不考虑立体异构)
D.利用乙醇的还原性以及Cr3+、![]() 的颜色差异来检验酒后驾车
的颜色差异来检验酒后驾车
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见有机物间的转化关系如图所示(以下变化中,某些反应条件及产物未标明)。A是天然有机高分子化合物,D是一种重要的化工原料。在相同条件下,G蒸气密度是氢气的44倍。
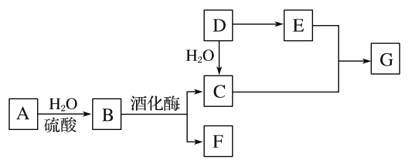
(1)D中官能团的名称:______________________________________。
(2)C和E反应的化学方程式:________________________。
(3)检验A转化过程中有B生成,先中和水解液,再需要加入的试剂是________________________________。
(4)某烃X的相对分子质量是D、F之和,分子中碳与氢的质量之比是5∶1。下列说法正确的是________(填字母)。
A.X 不溶于水,与甲烷互为同系物
B.X性质稳定,高温下不会分解
C.X不存在含有3个甲基的同分异构体
D.X可能和溴水发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)均三甲苯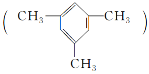 是一种易燃、不溶于水、比水密度小的有毒液体,是重要的有机化工原料,用于制备合成树脂、抗氧化剂等。
是一种易燃、不溶于水、比水密度小的有毒液体,是重要的有机化工原料,用于制备合成树脂、抗氧化剂等。
①均三甲苯属于苯的同系物,选用一种试剂区别苯和均三甲苯:________________。
②均三甲苯分子中的一个H原子被Cl原子取代,所得产物有________种。
(2)已知有机物: 。
。
①1mol该物质和足量溴水混合,消耗Br2的物质的量为___mol。
②下列说法不正确的是___(填序号)。
A.该有机物可发生加成、取代、氧化等反应
B.该有机物和甲苯属于同系物
C.该有机物使溴水褪色的原理与乙烯相同
D.该有机物能使酸性KMnO4溶液褪色,发生的是加成反应
(3)请完成下列转化的化学方程式(注明反应条件)
①甲苯与浓硝酸、浓硫酸混合制TNT_________。
②实验室制乙炔___________。
(4)萘的结构简式为![]() ,存在于煤焦油中,所有原子均处于同一平面内,则1mol萘最多能和___ mol的H2加成,写出萘的所有一氯代物的结构简式______。
,存在于煤焦油中,所有原子均处于同一平面内,则1mol萘最多能和___ mol的H2加成,写出萘的所有一氯代物的结构简式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 和
和![]() 都是锂离子电池的电极材料,可利用钛铁矿
都是锂离子电池的电极材料,可利用钛铁矿![]() 主要成分为
主要成分为![]() ,还含有少量MgO、
,还含有少量MgO、![]() 等杂质
等杂质![]() 来制备,工艺流程如下:
来制备,工艺流程如下:
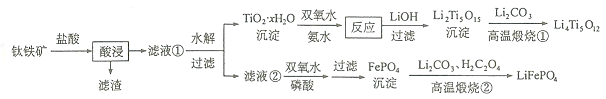
回答下列问题:
![]() “酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为
“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为![]() 时,所采用的实验条件为______。
时,所采用的实验条件为______。
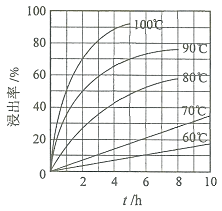
![]() “酸浸”后,钛主要以
“酸浸”后,钛主要以![]() 形式存在,写出相应反应的离子方程式______。
形式存在,写出相应反应的离子方程式______。
![]() 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度 | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | span>88 |
分析![]() 时
时![]() 转化率最高的原因______。
转化率最高的原因______。
![]() 中Ti的化合价为
中Ti的化合价为![]() ,其中过氧键的数目为______。
,其中过氧键的数目为______。
![]() 若“滤液
若“滤液![]() ”中
”中![]() ,加入双氧水和磷酸
,加入双氧水和磷酸![]() 设溶液体积增加1倍
设溶液体积增加1倍![]() ,使
,使![]() 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中![]() ,此时是否有
,此时是否有![]() 沉淀生成?______
沉淀生成?______![]() 列式计算
列式计算![]() 。
。![]() 、
、![]() 的
的![]() 分别为
分别为![]() 、
、![]()
![]() 写出“高温煅烧
写出“高温煅烧![]() ”中由
”中由![]() 制备
制备![]() 的化学方程式______。
的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备 1,2二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O CH2=CH2+Br2―→BrCH2CH2Br
CH2=CH2+H2O CH2=CH2+Br2―→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用少量溴和足量的乙醇 制备1,2-二溴乙烷的装置如下图所示:
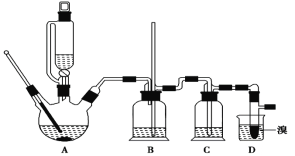
有关数据列表如下:
乙醇 | 1 ,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0 .79 | 2.2 | 0 .71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_________。(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置 C 中应加入________,其目的是吸收反应中可能生成的酸性气体。(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断 1,2-二溴乙烷制备反应已经结束的最简单方法是_________________________。
(4)将 1,2 二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在__________________层(填“上”、“下”)。
(5)若产物中有少量未反应的 Br2,最好用___________洗涤除去。(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用_____的方法除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com