
【题目】 已知下列两个气态物质之间的反应:
C2H2(g)+H2(g)![]() C2H4(g)①
C2H4(g)①
2CH4(g)![]() C2H4(g)+2H2(g)②
C2H4(g)+2H2(g)②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
(Q1、Q2、Q3均为正值)
C(s)+2H2(g)=CH4(g)ΔH=-Q1
2C(s)+H2(g)=C2H2(g)ΔH=-Q2
2C(s)+2H2(g)=C2H4(g)ΔH=-Q3Q值大小比较正确的是( )
A. Q1>Q3>Q2 B. Q1>Q2>Q3 C. Q2>Q1>Q3 D. Q3>Q1>Q2
【答案】A
【解析】
试题分析:当温度降低时,反应①的平衡向正反应方向移动,说明该反应正向为放热反应,△H<0,反应②的平衡向逆反应方向移动,说明该反应正向为吸热反应,△H>0,已知下列两个气态物质之间的反应:C2H2(g)+H2(g)C2H4(g)…①,2CH4(g)C2H4(g)+2H2(g)…②,已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:(1)C(s)+2H2(g)CH4(g),△H=-Q1…Ⅰ,(2)C(s)+![]() H2(g)
H2(g)![]() C2H2(g),△H=-Q2…Ⅱ,(3)C(s)+H2(g)
C2H2(g),△H=-Q2…Ⅱ,(3)C(s)+H2(g)![]() C2H4(g),△H=-Q3…Ⅲ,利用盖斯定律,2×[(3)-(2)],得到C2H2(g)+H2(g)C2H4(g),△H=2(Q2-Q3),与题干中的①中的方程式一样,而①中的反应为放热反应,则Q2-Q3<0,所以Q2<Q3;同理:2×[(3)-(1)],得到2CH4(g)C2H4(g)+2H2(g),△H=2(Q1-Q3),与题干中的②中的方程式一样,而②中的反应为吸热反应,则2(Q1-Q3)>0,所以Q1>Q3;综上所述Q1>Q3>Q2,故选A。
C2H4(g),△H=-Q3…Ⅲ,利用盖斯定律,2×[(3)-(2)],得到C2H2(g)+H2(g)C2H4(g),△H=2(Q2-Q3),与题干中的①中的方程式一样,而①中的反应为放热反应,则Q2-Q3<0,所以Q2<Q3;同理:2×[(3)-(1)],得到2CH4(g)C2H4(g)+2H2(g),△H=2(Q1-Q3),与题干中的②中的方程式一样,而②中的反应为吸热反应,则2(Q1-Q3)>0,所以Q1>Q3;综上所述Q1>Q3>Q2,故选A。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) △H1=-395kJ/mol,
CO(g)+1/2O2(g)=CO2(g) △H2=-283kJ/mol,
则反应C(s)+1/2O2(g)=CO(g)的反应热△H3等于 ( )
A. -112 kJ/mol B. -395 kJ/mol C. + 112 kJ/mol D. -283 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学过了物质的量浓度的概念后,你认为1 mol/L硫酸溶液的含义应是( )
A.每1 L水中含有1 mol H2SO4
B.每1 L溶液中含1 mol H+
C.将98 g H2SO4溶于1 L水中所配成的溶液
D.指每1 L硫酸溶液中含有98 g H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.离子化合物中可以含有共价键,但共价化合物中一定不含离子键
B.含有共价键的物质一定是共价化合物
C.分子中一定含有化学键
D.含有金属元素的离子一定是阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列叙述正确的是
A. 1 mol/L氯化铜溶液中的Cu2+数小于NA
B. 标准状况下,22.4 L Cl2与水反应转移的电子数为NA
C. 28 g聚乙烯含有的碳原子数为2NA
D. 惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质能使品红溶液褪色,且褪色原理基本相同的是( )
①活性炭
②氯水
③二氧化硫
④臭氧
⑤过氧化钠
⑥双氧水.
A.①②④
B.②③⑤
C.②④⑤⑥
D.③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示氮及其化合物在一定条件下的转化关系:
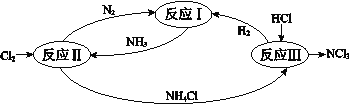
(1)根据反应I,在500℃、20MPa时,将N2和H2通入到体积为2 L的密闭容器中,反应过程中各种物质的物质的量变化如右图所示:

(1)10 min内用NH3表示该反应的平均速率,v(NH3)= 。
(2)在10~20min内NH3浓度变化的原因可能是 (填字母)。
a.加了催化剂
b.降低温度
c.增加NH3的物质的量
(3)该可逆反应达到平衡的标志是_______(填字母)。
a.3v(H2)正 = 2v(NH3)逆
b.混合气体的密度不再随时间变化
c.容器内的总压强不再随时间而变化
d. N2、H2、NH3的分子数之比为1∶3∶2
(4)第一次平衡时,平衡常数K1= (用数学表达式表示)。
(5)反应I:N2(g)+3H2(g)![]() 2NH3(g) ΔH=–92.4 kJmol-1
2NH3(g) ΔH=–92.4 kJmol-1
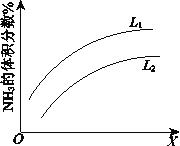
如图所示反应I中平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是____________(填“温度”或“压强”),判断L1、L2的大小关系并说明理由_______ 。
(6)反应II其中一步反应为
2NH3 (g)+3Cl2(g) =N2 (g) +6HCl(g) ΔH=–462 kJmol-1
已知:![]()
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为_________ kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有足量A的体积可变的密闭容器中,保持压强一定,加入B,发生反应:A(s)+2B(g) ![]() 4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是( )
4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是( )
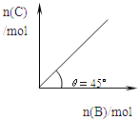
①若当温度升高后,则图中θ>45°
②若再加入B,则正、逆反应速率均逐渐增大
③若再加入B,则再次达到平衡时反应体系气体密度不变
④平衡时B的转化率为50%
A.①③ B.②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁与冷水、热水均不反应,但与水蒸气可以反应。
资料显示,在不同温度下,铁粉与水蒸气反应的产物不同,温度低于570 ℃时,生成FeO,高于570℃时,生成Fe3O4。
某研究性学习小组用如图所示实验装置,完成还原铁粉与水蒸气反应的实验,并分析研究产物的组成。
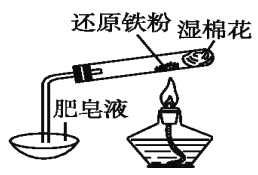
(1)肥皂液的作用是____________。
(2)甲同学为探究实验后试管内的固体含有哪些物质,进行了如下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈绿色,有少量气泡产生 |
② | 向试管中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据上述实验,能确定固体中一定存在的物质是______________,由②的操作及现象,能否确定反应产物中不含有Fe3O4?________。(填“能”或“不能”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com