
【题目】已知:C(s)+O2(g)=CO2(g) △H1=-395kJ/mol,
CO(g)+1/2O2(g)=CO2(g) △H2=-283kJ/mol,
则反应C(s)+1/2O2(g)=CO(g)的反应热△H3等于 ( )
A. -112 kJ/mol B. -395 kJ/mol C. + 112 kJ/mol D. -283 kJ/mol
科目:高中化学 来源: 题型:
【题目】19世纪中叶,俄国化学家门捷列夫对化学学科的巨大贡献是( )
A.提出了原子学说
B.提出了元素周期律
C.提出了分子学说
D.制定了科学的元素周期表
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
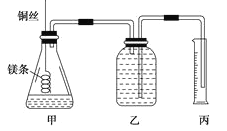
② 配制100mL.1.0mol·L-1的盐酸溶液;
②用__________(填仪器名称并注明规格)量取10.0mL 1.0mol·L-1的盐酸溶液加入锥形瓶甲中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为__________g;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题。
(1)步骤①中,配制100mL 1.0mol·L-1的盐酸溶液时,下列哪些操作会使配制浓度偏小________(填写字母)。
A.用量筒量取浓盐酸时,俯视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓盐酸在烧杯中稀释时,搅拌时间过长
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
(2)请填写操作步骤中的空格:步骤②_________,步骤③_________g。
(3)实验步骤⑤中应选用____________(填字母)的量筒;
A.100mL B.200mL C.500mL
读数时除恢复到室温,调节乙丙内液面相平外,还要注意 。
(4)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为Vm=____________L/mol。
(5)若未除去镁条表面的氧化镁,则测得该条件下气体的摩尔体积 (填偏大、偏小或无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS。某同学用15.0 g该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:
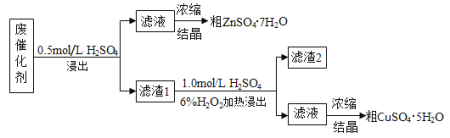
已知:ZnS与稀硫酸反应,且化合价不变;CuS不与稀硫酸反应。回答下列问题:
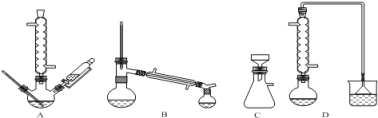
(1)在下列装置中,第一次浸出必须用 。(填标号)
(2)第二次浸出时,向盛有滤渣1的反应器中先加入稀H2SO4,后滴入H2O2溶液。
①写出第二次浸出(有单质生成)的化学方程式 。
②若滴加H2SO4和H2O2顺序相反,会造成 。
③滤渣2的主要成分是 。
CuS+H2O2+H2SO4=CuSO4+S+2H2O
(3)浓缩硫酸锌、硫酸铜溶液使用的主要仪器名称是 。
(4)该同学在实验完成之后,得到1.50g CuSO4·5H2O,则铜的回收率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是( )

A.4Fe(OH)2+O2+2H2O=4Fe(OH)3
B.2H2O2![]() 2H2O+O2↑
2H2O+O2↑
C.3CO+Fe2O3![]() 3CO2+2Fe
3CO2+2Fe
D.Zn+H2SO4 = ZnSO4+H2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列气体的检验方法中,正确的是
A. 用澄清石灰水鉴别SO2 和CO2 B. 用酸性高锰酸钾溶液鉴别乙烯和乙炔
C. 用湿润的淀粉-KI 试纸检验 Cl2 D. 用湿润的蓝色石蕊试纸检验氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是

A.图1中电解质溶液的pH增大
B.图2中电解AlCl3溶液的总反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.A处通入的气体为CH4,电极反应式为CH4+10OH--8e-= CO32-+7H2O
D.电解池中Cl-向x极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过用水溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( )
A.硝酸钾、氢氧化钠 B.氧化铜、二氧化锰
C.氯化钾、二氧化锰 D.硫酸铜、氢氧化钡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 已知下列两个气态物质之间的反应:
C2H2(g)+H2(g)![]() C2H4(g)①
C2H4(g)①
2CH4(g)![]() C2H4(g)+2H2(g)②
C2H4(g)+2H2(g)②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
(Q1、Q2、Q3均为正值)
C(s)+2H2(g)=CH4(g)ΔH=-Q1
2C(s)+H2(g)=C2H2(g)ΔH=-Q2
2C(s)+2H2(g)=C2H4(g)ΔH=-Q3Q值大小比较正确的是( )
A. Q1>Q3>Q2 B. Q1>Q2>Q3 C. Q2>Q1>Q3 D. Q3>Q1>Q2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com