
【题目】
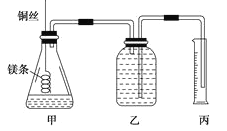
② 配制100mL.1.0mol·L-1的盐酸溶液;
②用__________(填仪器名称并注明规格)量取10.0mL 1.0mol·L-1的盐酸溶液加入锥形瓶甲中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为__________g;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题。
(1)步骤①中,配制100mL 1.0mol·L-1的盐酸溶液时,下列哪些操作会使配制浓度偏小________(填写字母)。
A.用量筒量取浓盐酸时,俯视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓盐酸在烧杯中稀释时,搅拌时间过长
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
(2)请填写操作步骤中的空格:步骤②_________,步骤③_________g。
(3)实验步骤⑤中应选用____________(填字母)的量筒;
A.100mL B.200mL C.500mL
读数时除恢复到室温,调节乙丙内液面相平外,还要注意 。
(4)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为Vm=____________L/mol。
(5)若未除去镁条表面的氧化镁,则测得该条件下气体的摩尔体积 (填偏大、偏小或无影响)。
【答案】(1)A C (2分)
(2)② 10mL量筒(1分)③ 0.12 (2分)
(3)B (2分)视线与凹液面最低处相平(2分)
(4)0.2V (2分)(5)偏小(2分)
【解析】试题分析:(1)A.用量筒量取浓盐酸时,俯视量筒的刻度,则量取的浓盐酸的体积偏小,所配置出的溶液的浓度偏低,故A正确;B.容量瓶未干燥即用来配制溶液,对溶液的浓度无影响,故B错误;C.浓盐酸在烧杯中稀释时,搅拌时间过长会导致HCl的挥发,则所配置的溶液的浓度偏低,故C正确;D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线是正常的,无影响,故D错误;E.在容量瓶中定容时俯视容量瓶刻度线,则溶液体积偏小,浓度偏高,故F错误;故选AC;
(2)步骤②量取10.0mL 1.0molL的盐酸溶液加入锥形瓶中,题中要求酸的体积10.0mL,故选用10mL量筒即可;
步骤③
Mg+2HCl═MgCl2+H2↑
1mol 2mol
n 0.01 mol
n="0.005mol" 故a=24g/mol×0.005mol=0.12g;
(3)Mg+2HCl═MgCl2+H2↑
2mol 1mol
0.01 mol n(H2)
n(H2)=0.005mol
V(H2)="0.005" mol×22.4L/mol=0.112L=56ml,应选200mL量筒;故答案为B;
(4)由(2)得气体的物质的量为0.005 mol,通过⑥的气体的体积为VmL,Vm=V/n=0.001VL÷0.005mol=0.2VL/mol;
(5)若未除去镁条表面的氧化膜,生成的氢气体积减少,则测量结果偏低。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如下图是课外活动小组的同学设计的 4 个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
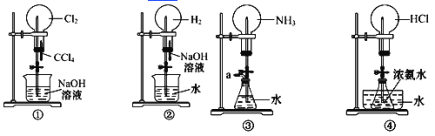
A.挤压装置①的胶头滴管使 CCl4。全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使 NaOH 溶液全部进入烧瓶,片刻后打开止水夹
C.用鼓气装置从装置③的 a 处不断鼓入空气并打开止水夹
D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积不变的容器中,通入2mol SO2和2mol O2及固体催化剂,使之反应。2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时
2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时
(1)加入2mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 ;
(2)保持同一反应温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g),欲使平衡时SO3的体积分数为2/9,
①达到平衡时,⑴与⑵放出的热量 (填序号)。
A.一定相等 B.前者一定小 C.前者大于或等于后者
②a、b、c必须满足的关系是 、 (一个用a、c表示,另一个用b、c表示),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,下列各组热化学方程式中,△H1<△H2是
A.C(s)+![]() O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2
O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2
B.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
C.2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2
D.S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ca(OH)2与Cl2反应的氧化物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应),生成物中含有Cl-、ClO-、ClO3-三种含氧元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线
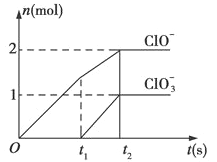
(1)t1前,氧化产物是___ ___(填化学式)。
(2)t2时,石灰乳与Cl2发生反应的总的离子方程式为:____ __。
(3)该反应中所消耗氯气的物质的量是______mol。
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是__________(填字母)。
A.NaCl、Cl2 B.NaCl、NaClO C.NaClO3、NaClO4 D.NaCl、NaClO3
(5)配平下列离子方程式:
_______Fe(OH)3+_______ClO-+_______OH-=_______FeO42-+_______Cl-+_______H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某同学用500 mL容量瓶配制0.10 mol·L-1Na2CO3溶液的步骤:
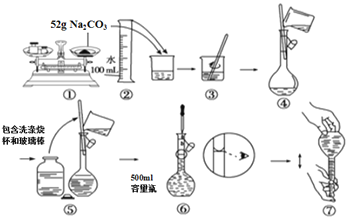
该同学的错误是
A. ①⑤⑥ B. ②④⑦ C. ①⑥ D. ⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) △H1=-395kJ/mol,
CO(g)+1/2O2(g)=CO2(g) △H2=-283kJ/mol,
则反应C(s)+1/2O2(g)=CO(g)的反应热△H3等于 ( )
A. -112 kJ/mol B. -395 kJ/mol C. + 112 kJ/mol D. -283 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学过了物质的量浓度的概念后,你认为1 mol/L硫酸溶液的含义应是( )
A.每1 L水中含有1 mol H2SO4
B.每1 L溶液中含1 mol H+
C.将98 g H2SO4溶于1 L水中所配成的溶液
D.指每1 L硫酸溶液中含有98 g H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com