
【题目】在一定温度下,向一个容积不变的容器中,通入2mol SO2和2mol O2及固体催化剂,使之反应。2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时
2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时
(1)加入2mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 ;
(2)保持同一反应温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g),欲使平衡时SO3的体积分数为2/9,
①达到平衡时,⑴与⑵放出的热量 (填序号)。
A.一定相等 B.前者一定小 C.前者大于或等于后者
②a、b、c必须满足的关系是 、 (一个用a、c表示,另一个用b、c表示),
【答案】
(1)78.4KJ;(2)①C ②a+c=2、b+1/2c=2。
【解析】
试题分析:(1)由题意气体压强为起始时的90%,则反应后总的物质的量为起使时的90%,平衡时总物质的量为(2mol+2mol)×90%=3.6mol,则平衡时各组成物质的量变化为:
2SO2+O2![]() 2SO3 物质的量减少△n
2SO3 物质的量减少△n
2 1 2 1
1.2mol 0.4mol 0.8mol (2mol+2mol)-3.6mol=0.4mol,
此时放出的热量为196.6KJ×![]() =78.4KJ,故答案为:78.4;
=78.4KJ,故答案为:78.4;
(2)原平衡时SO3的体积分数为![]() =
=![]() ,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,平衡时SO3的体积分数为
,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,平衡时SO3的体积分数为![]() ,则与原平衡为等效平衡,c>0,说明(2)比(1)反应的少,放热就少,故答案为:C;
,则与原平衡为等效平衡,c>0,说明(2)比(1)反应的少,放热就少,故答案为:C;
(3)原平衡时SO3的体积分数为![]() =
=![]() ,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,平衡时SO3的体积分数为
,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,平衡时SO3的体积分数为![]() ,则与原平衡为等效平衡,则a+c=2, b+0.5c=2,故答案为:a+c=2; b+0.5c=2。
,则与原平衡为等效平衡,则a+c=2, b+0.5c=2,故答案为:a+c=2; b+0.5c=2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列十种物质:①O2;②Fe;③CaO;④CO2;⑤H2SO4;⑥Ba(OH)2;⑦红褐色的氢氧化铁胶体;⑧硫酸钠溶液;⑨稀硝酸;⑩Cu2(OH)2CO3。
(1)按物质的树状分类法填写表格的空白处:
分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
属于该类的物质 | ② | _____ | ⑧⑨ | _____ |
(2)上述物质中属于非电解质的有_________;上述物质中能与盐酸反应的电解质有________。
Ⅱ.(1)在 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 的反应中,氧化剂是_________,还原产物是_________,氧化产物与还原产物的质量比是_________。
(2)在反应MnO2+4HCl=MnCl2+Cl2↑+2H2O中,每生成标准状况下4.48LCl2,转移电子的数目为___________。
Ⅲ.Mn2+、Bi3+、BiO3-、MnO4-、H+、H2O组成的一个氧化还原反应体系中,发生BiO3-→Bi3+的反应过程,据此回答下列问题:
将以上物质分别填入下面对应的横线上,组成一个未配平的化学方程式。
________+ _________+ ________![]() _________+ ________+H2O
_________+ ________+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】19世纪中叶,俄国化学家门捷列夫对化学学科的巨大贡献是( )
A.提出了原子学说
B.提出了元素周期律
C.提出了分子学说
D.制定了科学的元素周期表
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能量转化过程与氧化还原反应无关的是
A. 锂离子电池放电时,化学能转化成电能
B. 硅太阳能电池工作时,光能转化成电能
C. 电解质溶液导电时,电能转化成化学能
D. 葡萄糖为人类生命活动提供能量时,化学能转化成热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化,不能通过一步反应完成的是( )
A.Na2CO3→Na2SiO3
B.SiO2→H2SiO3
C.Cu→CuSO4
D.SiO2→Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于丙烯(CH3—CH =CH2)的说法正确的( )
A. 丙烯分子有6个σ键,1个π键 B. 丙烯分子中3个碳原子都是sp3杂化
C. 丙烯分子存在非极性键 D. 丙烯分子中3个碳原子在同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
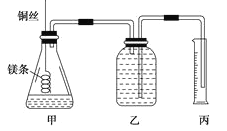
② 配制100mL.1.0mol·L-1的盐酸溶液;
②用__________(填仪器名称并注明规格)量取10.0mL 1.0mol·L-1的盐酸溶液加入锥形瓶甲中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为__________g;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题。
(1)步骤①中,配制100mL 1.0mol·L-1的盐酸溶液时,下列哪些操作会使配制浓度偏小________(填写字母)。
A.用量筒量取浓盐酸时,俯视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓盐酸在烧杯中稀释时,搅拌时间过长
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
(2)请填写操作步骤中的空格:步骤②_________,步骤③_________g。
(3)实验步骤⑤中应选用____________(填字母)的量筒;
A.100mL B.200mL C.500mL
读数时除恢复到室温,调节乙丙内液面相平外,还要注意 。
(4)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为Vm=____________L/mol。
(5)若未除去镁条表面的氧化镁,则测得该条件下气体的摩尔体积 (填偏大、偏小或无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是

A.图1中电解质溶液的pH增大
B.图2中电解AlCl3溶液的总反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.A处通入的气体为CH4,电极反应式为CH4+10OH--8e-= CO32-+7H2O
D.电解池中Cl-向x极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com