
【题目】下列能量转化过程与氧化还原反应无关的是
A. 锂离子电池放电时,化学能转化成电能
B. 硅太阳能电池工作时,光能转化成电能
C. 电解质溶液导电时,电能转化成化学能
D. 葡萄糖为人类生命活动提供能量时,化学能转化成热能
科目:高中化学 来源: 题型:
【题目】非金属元素R其质量数为127,又知R离子含有74个中子,54个电子,则该元素最高化合价组成的化合物是( )
A.R(OH)3
B.R2O7
C.HRO3
D.H2R
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浓度相等、体积均为50 mL 的 A、B 两份NaOH 溶液中,分别通入一定量的CO2后,再稀释到100 mL。
(1)在 NaOH 溶液中通入一定量的 CO2 后,溶液中溶质的可能组成是
①_________, ②________, ③________, ④________。
(2)在稀释后的溶液中逐滴加入0.2 mol/L 的盐酸,产生 CO2 的体积(标准状况)与所加盐酸的体积关系如图所示。
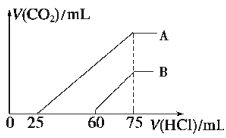
①A 曲线表明,原溶液通入CO2后,所得溶质与盐酸反应产生 CO2 的最大体积是_________mL(标准状况)。
②B 曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为______________。
③原 NaOH 溶液的物质的量浓度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
A.用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-=O2↑+4H+
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C.将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4
D.H3PO2溶于水时电离方程式为:H3PO2![]() H++H2PO22-
H++H2PO22-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A. HX、HY、HZ B. HX、HZ、HY
C. HZ、HY、HX D. HY、HZ、HX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积不变的容器中,通入2mol SO2和2mol O2及固体催化剂,使之反应。2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时
2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时
(1)加入2mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 ;
(2)保持同一反应温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g),欲使平衡时SO3的体积分数为2/9,
①达到平衡时,⑴与⑵放出的热量 (填序号)。
A.一定相等 B.前者一定小 C.前者大于或等于后者
②a、b、c必须满足的关系是 、 (一个用a、c表示,另一个用b、c表示),
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ca(OH)2与Cl2反应的氧化物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应),生成物中含有Cl-、ClO-、ClO3-三种含氧元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线
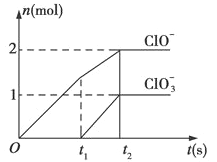
(1)t1前,氧化产物是___ ___(填化学式)。
(2)t2时,石灰乳与Cl2发生反应的总的离子方程式为:____ __。
(3)该反应中所消耗氯气的物质的量是______mol。
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是__________(填字母)。
A.NaCl、Cl2 B.NaCl、NaClO C.NaClO3、NaClO4 D.NaCl、NaClO3
(5)配平下列离子方程式:
_______Fe(OH)3+_______ClO-+_______OH-=_______FeO42-+_______Cl-+_______H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中CO2的含量及有效利用,已经引起各国的普遍重视
Ⅰ:目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.
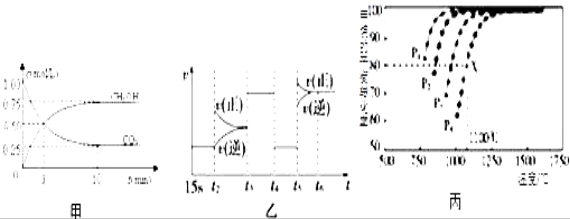
(1)前3min内,平均反应速率v(H2)=_________ _____.此温度下该反应的平衡常数为____________(保留两位小数).
(2)下列措施中,既能使反应加快,又能使![]() 增大的是___________.
增大的是___________.
A.升高温度 B.充入惰性气体 C.将H2O(g)从体系中分离 D.再充入1mol H2
(3)图乙中t5时引起平衡移动的条件是_____________.(填序号)
A.升高温度 B.增大反应物浓度 C.使用催化剂 D.增大体系压强
(4)反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,化学平衡____________(填“正向”、“逆向”或“不”)移动.
Ⅱ:利用CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)将CO2转化成燃料气.T℃时,在恒容密闭容器中通入物质的量均为0.1mol的CH4与CO2,发生上述反应,测得CH4的平衡转化率与温度及压强的关系如图所示,
2CO(g)+2H2(g)将CO2转化成燃料气.T℃时,在恒容密闭容器中通入物质的量均为0.1mol的CH4与CO2,发生上述反应,测得CH4的平衡转化率与温度及压强的关系如图所示,
(5)下列事实能说明该反应达到平衡的是_______________
a.CO的物质的量不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO2)=2v逆(H2)
d.混合气体压强不再发生变化
e.单位时间内生成n mol CH4的同时消耗2n mol H2
(6)据图可知P1、P2、P3、P4由小到大的顺序是__________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com