
有关下列离子方程式的说法正确的是
A.向NH4HCO3溶液中加过量的NaOH溶液并加热: NH4+ +OH-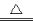 NH3↑+H2O
NH3↑+H2O
B.向NaAlO2溶液中通入过量CO2的反应为:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32—
C.等物质的量的FeBr2与Cl2反应为:2Fe2++2Br—+2Cl2=2Fe3++Br2+4Cl—
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4— + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源:2015-2016学年吉林省白城市高一上第一次月考化学试卷(解析版) 题型:选择题
下列实验操作:①用50 mL量筒量取5 mL蒸馏水;②称量没有腐蚀性固体药品时,把药品放在托盘上称量;③倾倒液体时试剂不对准容器口;④块状药品都要用药匙取用;⑤固体药品用广口瓶保存.其中不正确的是
A.①②③④ B.③④
C.②⑤ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省天水市高三上第一次检测考试化学试卷(解析版) 题型:实验题
(15分)三苯甲醇( )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。


已知:(I)格氏试剂容易水【解析】
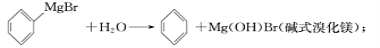
(Ⅱ)相关物质的物理性质如下:
物质 | 熔点 | 沸点 | 溶解性[ |
三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
(Ⅲ)三苯甲醇的相对分子质量是260。
请回答以下问题:
(1)装置中玻璃仪器B的名称为 ;装有无水CaCl2的仪器A的作用是 。
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是 ;制取格氏试剂时要保持温度约为40℃,可以采用 加热方式。
(3)制得的三苯甲醇粗产品经过初步提纯,仍含有氯化铵杂质,可以设计如下提纯方案:
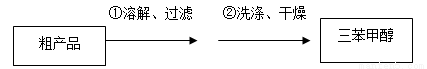
其中,洗涤液最好选用 (填字母序号)。
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为 。
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80 mL。则产品中三苯甲醇的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省三门峡市高二上学期入学考试化学试卷(解析版) 题型:选择题
已知反应:mX(g)+nY(g)  qZ(g) ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法中正确的是
qZ(g) ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法中正确的是
A.通入稀有气体使压强增大,平衡将向正反应方向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
电瓶车所用电池一般为铅蓄电池(如图),这是一种典型的可充电电池,电池总反应式为: Pb+PbO2+2H2 SO4 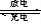 2Pb SO4+2H2O。则下列说法正确的是
2Pb SO4+2H2O。则下列说法正确的是
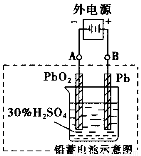
A.放电时,负极板上发生了还原反应
B.放电时,正极反应是:Pb一2e一+ SO42—=PbSO4
C.充电时,铅蓄电池的负极应与充电器电源的正极相连
D.充电时,阳极反应是:PbSO4一2e一+2H2O= PbO2+ SO42—+4H+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西太原五中高二上第一周考理科化学试卷(解析版) 题型:填空题
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。

根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是_____________;
(2)PCl5分解成PCl3和Cl2的热化学方程式是_______________。
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于 ;
(3)P和Cl2分两步反应生成1 mol PCl5的反应热ΔH3= ,P和Cl2一步反应生成1 mol PCl5的ΔH4 ΔH3(填“大于”、“小于”或“等于”);
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是____________________。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省双鸭山市高三上第一次月考化学试卷(解析版) 题型:填空题
(14分)X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)。
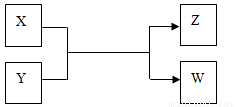
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)向FeCl2溶液中加入X的水溶液,是溶液颜色变为棕黄色的微粒是 。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途 。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是 。
Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1)X与Y反应的化学方程式是 。
(2)若用下列装置只进行Z + W X + Y反应(夹持装置未画出):
X + Y反应(夹持装置未画出):
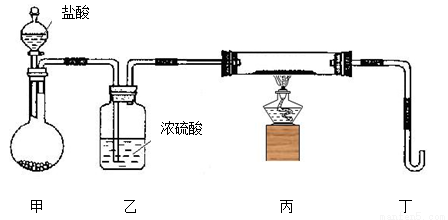
①完成此实验有多步操作,其中三步是:a.点燃酒精灯,b.滴加盐酸,c.检验气体纯度
这三步操作的先后顺序是 (填字母)。
②为保证实验成功,上述装置需要改进,方法是(用文字叙述) 。
(3)将3.48 g Z加入50 mL 4 mol/L的稀HNO3中充分反应,产生112 mL的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀。当沉淀量最多时,至少需要加入2 mol/L的NaOH溶液 mL (精确到0.1)。
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三上学期开学考试化学试卷(解析版) 题型:选择题
下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是
A.Fe B.Na C.Al D.K
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上化学试卷(解析版) 题型:填空题
(10分)向某密闭容器中加入0.15 mol/L A、0.05 mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0时c(B)未画出,t1时增大到0.05 mol/L]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。

(1)若t1=15s,则t0~t1阶段v(C)=______ _,A的转化率为______ __。
(2)若t5时改变的条件是升温,此时v(正)>v(逆),若A的物质的量减少0.03 mol时,容器与外界的热交换总量为akJ,写出该反应的热化学方程式 。
(3)若t4时改变的条件为减小压强,则B的起始物质的量浓度为____ _mol/L。
(4)t3时改变的某一反应条件可能是_______ _(选填序号)。
a.使用催化剂 b.增大压强 c.增大反应物浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com