
��14�֣�X��Y��Z��W���������������ת����ϵ������X��W���ʣ�Y��ZΪ������,δ�г���Ӧ��������
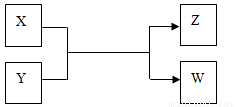
����Z�������г��õĵ�ζƷ��W��������Һ��������
��1����FeCl2��Һ�м���X��ˮ��Һ������Һ��ɫ��Ϊ�ػ�ɫ������ ��
��2����ҵ��Z�ж�����;���û�ѧ����ʽ��ʾZ��һ����; ��
��3�����������õ�Z�����˵���أ�����X��Y��Һ��Ӧʱ���Եõ�һ�ֵ����Σ��˷�Ӧ�����ӷ���ʽ�� ��
����X�ǹ�ҵ���������Ľ������ʣ�Z��һ�־��д��Եĺ�ɫ���壬��
��1��X��Y��Ӧ�Ļ�ѧ����ʽ�� ��
��2����������װ��ֻ����Z + W X + Y��Ӧ���г�װ��δ��������
X + Y��Ӧ���г�װ��δ��������
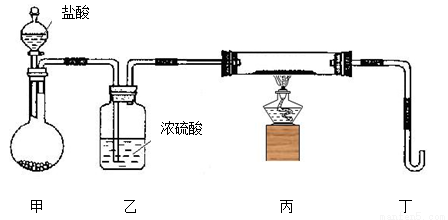
����ɴ�ʵ���жಽ���������������ǣ�a����ȼ�ƾ��ƣ�b���μ����ᣬc���������崿��
�������������Ⱥ�˳���� ������ĸ����
��Ϊ��֤ʵ��ɹ�������װ����Ҫ�Ľ��������ǣ������������� ��
��3����3.48 g Z����50 mL 4 mol/L��ϡHNO3�г�ַ�Ӧ������112 mL��NO����״��������Ӧ�����Һ�еμ�NaOH��Һ�ܲ��������������������ʱ��������Ҫ����2 mol/L��NaOH��Һ mL ����ȷ��0.1����
 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�ʡ�����и߶��ϵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ������ԣ�˵����ȷ����
A��pH��7����Һ������
B��������Һ��һ����c(H��)��1.0��10��7mol��L��1
C��c(OH��)��c(H��)����Һ������
D����100 ��ʱ����ˮ��pH<7����˳�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ����Ȫʮ���и�����һ�νο��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ɫ��Һ�У����������ܴ���������ǣ�
A��NH4+��Na+��S2����ClO�� B��K +��SO42����OH����AlO2��
C��K +��Fe3+ ��Cl����NO3�� D��Ba2+ ��Na+ ��OH����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����һ�и������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�й��������ӷ���ʽ��˵����ȷ����
A����NH4HCO3��Һ�мӹ�����NaOH��Һ�����ȣ� NH4+ +OH-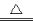 NH3��+H2O
NH3��+H2O
B����NaAlO2��Һ��ͨ�����CO2�ķ�ӦΪ��2AlO2��+CO2+3H2O=2Al(OH)3��+CO32��
C�������ʵ�����FeBr2��Cl2��ӦΪ��2Fe2++2Br��+2Cl2=2Fe3++Br2+4Cl��
D����Ũ�����ữ��KMnO4��Һ��H2O2��Ӧ��֤��H2O2���л�ԭ�ԣ�2MnO4�� + 6H+ + 5H2O2 = 2Mn2+ + 5O2�� + 8H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��̫ԭ���и߶��ϵ�һ�ܿ����ƻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���������ɷ������·�Ӧ��P4 + 5O2 === P4O10����֪�������л�ѧ����Ҫ���յ������ֱ�Ϊ��P��P a kJ��mol��1��P��O b kJ��mol��1��P��O c kJ��mol��1��O��O d kJ��mol��1������ͼʾ�ķ��ӽṹ���й����ݹ���÷�Ӧ�ġ�H��������ȷ����

A����6a + 5d��4c��12b��kJ��mol��1
B����4c + 12b��6a��5d��kJ��mol��1
C����4c + 12b��4a��5d��kJ��mol��1
D����4a + 5d��4c��12b��kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꼪��ʡ��һ��ѧ����ѧ�Ծ��������棩 ���ͣ������
��8��)��һ����ɫ��������û������ܺ���CuSO4��Na2CO3��Na2SO4��MgCl2���ֽ�������ʵ�飺
��1�������������ˮ���õ���ɫ����Һ��
��2��ȡ������Һ�ֳ�����ʢ���Թ��У�����һ�ݵμ�BaCl2��Һ��������ɫ�������ټ�ϡ���ᣬ�������ܽ⣻��һ�ݵμ�NaOH��Һ���а�ɫ�������ɡ��Ը���ʵ�������ƶϣ�������������գ�
�û�����п϶�û��________��________���϶�����________��________��д��ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꼪��ʡ�߶�9�¼�⻯ѧ�Ծ��������棩 ���ͣ������
��X��Y��Z��W���ֶ�����Ԫ�أ�ԭ��������������X�������Ӿ���һ�����ӡ�Z��W�����ڱ��д�������λ�ã����ǵĵ�����ͨ��״���¾�Ϊ��ɫ���塣Yԭ�ӵ������������Ǵ�����������2������ش�
��1��Y��ԭ�ӽṹʾ��ͼΪ ��YW2�ĽṹʽΪ ��
��2����X2��W2����ͼ��ʾͨ��ijȼ�ϵ���У����У�b�缫�ĵ缫��ӦʽΪ ��

����16gW2�μӷ�Ӧ��ת�Ƶĵ����� NA��
��3����X��Y��Z��W����Ԫ����ɵ�������ʽ�Σ���������NaOH��Һ�ڼ��������·�Ӧ�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����Ļ�������������һ�и�����ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ��ƶ���
��14�֣���֪A��K�������ĸ����ʶ�����ѧ��ѧ�ﳣ�������ʣ���I�Ǿ��д��Ե����ʣ�D��K���������ԡ�һ�������£������ʼ�����Ӧת����ϵ����ͼ��ʾ��
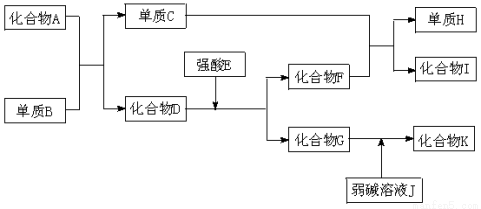
��ش�
��1��д���й����ʻ�ѧʽ��D�� ��H�� ��
��2��д�����з�Ӧ�ķ���ʽ��
�ٻ�����G����Һ�� �����ԣ����ԣ����ԣ�����ԭ�������ӷ���ʽ��ʾΪ ��
��д��C��F H��I�Ļ�ѧ����ʽ���õ����ű�ʾ��Ӧ�����е���ת�Ƶķ������Ŀ ��
H��I�Ļ�ѧ����ʽ���õ����ű�ʾ��Ӧ�����е���ת�Ƶķ������Ŀ ��
��G��J K�����ӷ���ʽ��ʾΪ ��
K�����ӷ���ʽ��ʾΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����������������ѧ�߶���9�¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���й����Ȼ�ѧ��Ӧ����������ȷ����
A����֪H��(aq)��OH��(aq)===H2O(l) ��H����57.3 kJ��mol��1����
2H��(aq)��SO42��(aq)��Ba2��(aq)��2OH��(aq)===BaSO4(s)��2H2O(l) ��H����114.6 kJ��mol��1
B��ȼ�ϵ���н��״�����ת��Ϊ�������Ȼ�ѧ����ʽ�ǣ�
CH3OH(g)��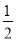 O2(g)===CO2(g)��2H2(g) ��H����192.9 kJ��mol��1��
O2(g)===CO2(g)��2H2(g) ��H����192.9 kJ��mol��1��
��CH3OH(g)��ȼ����Ϊ192.9 kJ��mol��1
C��H2(g)��ȼ������285.8 kJ��mol��1����2H2O(g)===2H2(g)��O2(g) ��H����571.6 kJ��mol��1
D�������ǵ�ȼ������2 800 kJ��mol��1����
 C6H12O6(s)��3O2(g)===3CO2(g)��3H2O(l) ��H����1 400 kJ��mol��1
C6H12O6(s)��3O2(g)===3CO2(g)��3H2O(l) ��H����1 400 kJ��mol��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com