
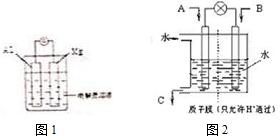
 电能与化学能之间的转化具有重要的使用价值.
电能与化学能之间的转化具有重要的使用价值.分析 (1)①当电解质溶液为稀硫酸时,Mg易失电子作负极、Al正极,负极镁被氧化,正极上氢离子得电子发生还原反应;
②当电解质溶液为氢氧化钠溶液时,该装置能自发进行氧化还原反应,能构成原电池,Al作负极、Mg作正极;
(2)由反应方程式可知:CO+2H2=CH3OH,碳的化合价降低发生还原反应,正极上是氧气发生得电子得还原反应;负极上二氧化硫失电子发生氧化反应,根据正极上电极反应式计算.
解答 解:(1)当电解质溶液为稀硫酸时,由于镁、铝都能与硫酸反应,且镁比铝活泼,则
①铝为原电池的正极,发生还原反应,电极方程式为2H++2e-=H2↑,故答案为:正;2H++2e-=H2↑;
②Al为负极,发生氧化反应,电极方程式为2Al-6e-+8OH-=2AlO2-+4H2O,故答案为;负;2Al-6e-+8OH-=2AlO2-+4H2O;
(2)由反应方程式可知:CO+2H2=CH3OH,碳的化合价降低发生还原反应,正极上是氧气发生得电子得还原反应;负极上二氧化硫失电子发生氧化反应,若A为SO2,B为O2,C为H2SO4时,负极上二氧化硫失电子和水反应生成硫酸,电极反应式为:SO2+2H2O-2e-=4H++SO42-,故答案为:正;SO2+2H2O-2e-=4H++SO42-.
点评 本题考查原电池原理,为高频考点,把握原电池的工作原理为解答的关键,侧重电极、电极反应的考查,注意不能直接利用金属活泼性判断负极,应从氧化还原反应的角度考虑,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温有利于提高反应的转化率 | |
| B. | 高温可增大反应的限度 | |
| C. | 700K时反应催化剂活性最强,反应速率更快 | |
| D. | 高温才可以自发向右进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
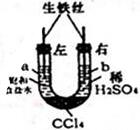 利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )
利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )| A. | a管发生吸氧腐蚀,b管发生析氢腐蚀 | |
| B. | 一段时间后,a管液面高于b管液面 | |
| C. | a处、b处溶液的pH都增大 | |
| D. | a、b两处具有相同的电极反应式:Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 在含有大量CO32-溶液中:NH4+、Na+、Cl-、H+ | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在强碱溶液中:Na+、K+、CO32-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Na+、Br-、SO42- | |
| B. | Al3+、Cl-、OH-、HCO3- | |
| C. | pH=0的溶液中:ClO-、SO42-、Fe2+、K+ | |
| D. | 由水电离的c(OH-)=10-14mol•L-1的溶液中:CH3COO-、SO42-、Na+、NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com