
【题目】已知1-丙醇和2-丙醇的结构简式如下:
1-丙醇:CH3-CH2-CH2-OH
2-丙醇:CH3-![]() -CH3
-CH3
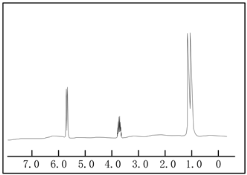
上图是这两种物质的其中一种的核磁共振谱,并且峰面积比分别为1:1:6,请指出该核磁共振谱为何物质,并说明原因_______。
【答案】2-丙醇;有三种峰,且峰面积比为1:1:6,说明有三种不同化学环境的氢原子,且原子个数比为1:1:6,只有2-丙醇符合,而1-丙醇不符合
【解析】
核磁共振谱中的峰面积比分别为1:1:6,说明该有机物分子中含有的不同位置氢原子有3种,分别含有氢原子数之比为1:1:6。
根据该有机物的核磁共振谱中的峰面积比分别为1:1:6可知:该有机物分子中含有的不同位置氢原子有3种,分别含有氢原子数之比为1:1:6,1﹣丙醇(CH3﹣CH2﹣CH2﹣OH}中不同位置的氢原子有四种,其数目之比为1:2:2:3;
2﹣丙醇![]() 中不同位置的氢原子有三种,其氢原子数目之比为1:1:6,所以满足条件的物质为:2﹣丙醇,
中不同位置的氢原子有三种,其氢原子数目之比为1:1:6,所以满足条件的物质为:2﹣丙醇,
故答案为:2-丙醇;有三种峰,且峰面积比为1:1:6,说明有三种不同化学环境的氢原子,且原子个数比为1:1:6,只有2-丙醇符合,而1-丙醇不符合。


科目:高中化学 来源: 题型:
【题目】某恒定温度下,在一个2L的密闭容器中充入A气体、B气体,其浓度分别为2 mol/L,1 mol/L,且发生如下反应:3A(g)+2B(g) 4C(?)+2D(?)已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后压强比为5:4,则下列说法中正确的是( )
①该反应的化学平衡常数表达式为:![]()
②此时B的转化率为35%
③增大该体系压强,平衡向右移动,但化学平衡常数不变
④增加C的量,A、B转化率不变
A. ①②B. ②③C. ③④D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是( )
A.短周期是指第1、2周期B.过渡元素全部是金属元素
C.元素周期表有8个副族D.IA族的元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于过滤和蒸发说法中不正确的是( )
A. 过滤常用来分离液体与固体混合物
B. 若使溶液中的溶质析出只能选用加热蒸发的方法
C. 过滤实验用到的仪器有烧杯、漏斗、玻璃棒、铁架台等
D. 蒸发实验用到的仪器有酒精灯、蒸发皿、玻璃棒、铁架台等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)11种元素中,化学性质最不活泼的是______。
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是________。
(3)②③④中形成的简单离子半径由大到小的顺序是________。
(4)元素⑥氢化物常温下和元素②的单质反应的离子方程式是_____________,该氢化物与元素⑧的单质反应的离子方程式是_________________________ 。
(5)①和⑨的最高价氧化物对应的水化物化学式为________和________。①和⑨两元素形成化合物的化学式为________,该化合物灼烧时焰色为________,该化合物的溶液与元素⑧的单质反应的离子方程式为__________________。
(6)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为________。
(7)⑥和⑧形成的化合物的化学式为________,该化合物溶解⑨的单质所得溶液为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1L水中(水的密度近似为1g·mL-1),所得溶液的物质的量浓度为c mol·L-1,密度为ρg·mL-1,质量分数为ω,则下列关系中不正确的是( )
A. ρ=![]() B. ω=17c/1000ρ
B. ω=17c/1000ρ
C. ω=17V/(17V +22400) D. C =1000Vρ/(17V + 22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
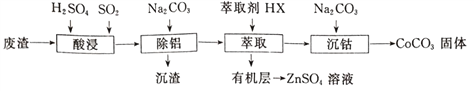
【题目】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式_________________。
(2)“除铝”过程中需要调节溶液pH的范围为______________,形成沉渣时发生反应的离子方程式为_____________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因_________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、X、W、D、E为短周期元素,且原子序数依次增大。A、D同主族,X、W同周期, X形成的气态氢化物可使湿润的红色石蕊试纸变蓝, A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为______________________。W的原子结构示意图为________。
(2)A、X 两种元素能形成含18电子的分子,请写出该分子的电子式:_______________。
用电子式表示化合物D2W的形成过程______________________________________。
(3)下列事实能说明W元素的非金属性比S元素的非金属性强的是________ (填字母)。
a.W单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol W单质比1 mol S得电子多
c.W和S两元素的简单氢化物受热分解,前者的分解温度高
(4)实验室制备A和X形成的气态化合物的化学方程式为____________________________。
(5)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式_________________________________________________________________________。
(6)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内存在着酸碱平衡,如出现失衡将对人体健康产生极大危害。人体内生成的下列酸属于无机物的是
A. 乳酸(C3H6O3) B. 磷酸(H3PO4)
C. 丙酮酸(C3H4O3) D. 乙酰乙酸(C4H6O3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com