
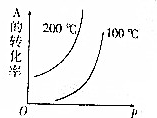
 对于可逆反应:mA(g)+nB(g)?pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:
对于可逆反应:mA(g)+nB(g)?pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:分析 (1)画一条等压辅助线,可看出温度越高,纵坐标A的转化率越大,故平衡正向移动,则正向为吸热反应;
(2)当温度相同时,从左往右压强增大,纵坐标A的转化率增大,则正向为气体体积缩小的反应;
(3)若将纵坐标A的转化率换成A在平衡混合物中的质量分数,因A的转化率越大则A在平衡混合物中的质量分数越小,则结果应相反,据此分析.
解答 解:(1)画一条等压辅助线,可看出温度越高,纵坐标A的转化率越大,故平衡正向移动,则正向为吸热反应,
故答案为:吸热;
(2)当温度相同时,从左往右压强增大,纵坐标A的转化率增大,则正向为气体体积缩小的反应,
故答案为:>;
(3)若将纵坐标A的转化率换成A在平衡混合物中的质量分数,因A的转化率越大则A在平衡混合物中的质量分数越小,则结果应相反,根据(1)(2)分析,则正反应是放热反应,逆反应是吸热反应,正向为气体体积增大的反应,即m+n<p+q,
故答案为:吸热;<.
点评 本题主要考查了化学平衡移动原理结合图象分析,可采用“定一议二”方法分析,题目难度不大.


 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 非金属原子间以共价键结合的物质都是共价化合物 | |
| B. | 金属元素和非金属元素不可能形成共价化合物 | |
| C. | 凡是能电离出离子的化合物都是离子化合物 | |
| D. | 离子化合物中可能有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
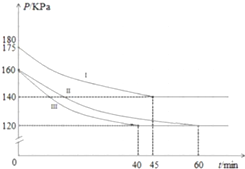 在10L恒容密闭容器中充入PCl3(g)和Cl2(g),发生反应:PCl3(g)+Cl2(g)?PCl5(g)起始时,PCl3(g)和Cl2(g)均为0.2mol,反应分别在Ⅰ、Ⅱ、Ⅲ三种条件下进行,其体系总压强随时间的变化如图所示.下列说法不正确的是( )
在10L恒容密闭容器中充入PCl3(g)和Cl2(g),发生反应:PCl3(g)+Cl2(g)?PCl5(g)起始时,PCl3(g)和Cl2(g)均为0.2mol,反应分别在Ⅰ、Ⅱ、Ⅲ三种条件下进行,其体系总压强随时间的变化如图所示.下列说法不正确的是( )| A. | 在实验Ⅲ中,从反应开始至达到平衡时,v(Cl2)=2.5×10-4mol/(L•min) | |
| B. | 实验Ⅲ跟实验Ⅱ相比,实验Ⅲ使用了催化剂 | |
| C. | 在实验Ⅱ中,反应的平衡常数K=100 | |
| D. | 该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
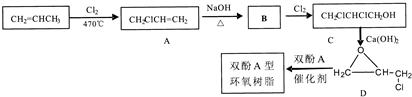
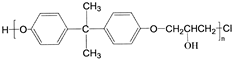
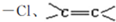 ,C的化学名称为2,3-二氯-1-丙醇.
,C的化学名称为2,3-二氯-1-丙醇.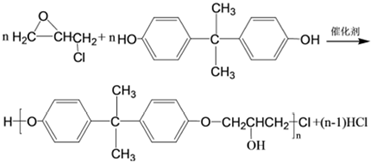
 为起始原料制备
为起始原料制备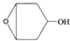 的合成路线:
的合成路线: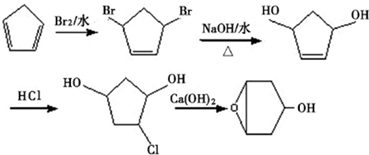 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应前各物质的物质的量/mol | |||
| A | B | C | |
| 甲 | 6 | 2 | 0 |
| 乙 | 0 | 0 | 6 |
| 丙 | 6 | 2 | 6 |
| A. | 带大平衡时,丙中A的溶度是甲中的2倍 | |
| B. | 若反应开始时向容器中加入A为2mol,B为0.5mol,C为3mol,则反应v(正)>v(逆) | |
| C. | 到达平衡时,甲中A的转化率等于乙中C的转化率 | |
| D. | 若保持恒温恒压,达到平衡后再向乙容器中再充入2molC,C的百分含量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
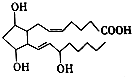 前列腺素F2α(PGF2α)的结构简式如图,下列有关PGF2α说法正确的是( )
前列腺素F2α(PGF2α)的结构简式如图,下列有关PGF2α说法正确的是( )| A. | PGF2α的分子式为C20H32O5 | |
| B. | 1mol PGF2α能与3molH2发生加成反应 | |
| C. | PGF2α不能使酸性高锰酸钾溶液褪色 | |
| D. | PGF2a在浓硫酸的作用下能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
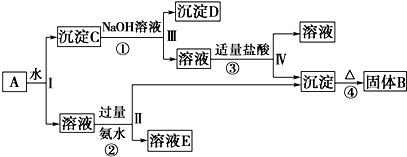
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B、C、D的离子半径大小比较:C>D>B | |
| B. | 元素E的最高价氧化物对应水化物的酸性比D的强 | |
| C. | 元素B分别与A、C形成的化合物中化学键的类型完全相同 | |
| D. | 均含A、B、C、D四种元素的化合物X和Y在溶液中可发生氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com