
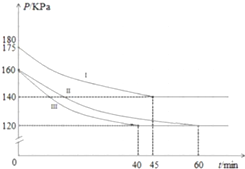
 在10L恒容密闭容器中充入PCl3(g)和Cl2(g),发生反应:PCl3(g)+Cl2(g)?PCl5(g)起始时,PCl3(g)和Cl2(g)均为0.2mol,反应分别在Ⅰ、Ⅱ、Ⅲ三种条件下进行,其体系总压强随时间的变化如图所示.下列说法不正确的是( )
在10L恒容密闭容器中充入PCl3(g)和Cl2(g),发生反应:PCl3(g)+Cl2(g)?PCl5(g)起始时,PCl3(g)和Cl2(g)均为0.2mol,反应分别在Ⅰ、Ⅱ、Ⅲ三种条件下进行,其体系总压强随时间的变化如图所示.下列说法不正确的是( )| A. | 在实验Ⅲ中,从反应开始至达到平衡时,v(Cl2)=2.5×10-4mol/(L•min) | |
| B. | 实验Ⅲ跟实验Ⅱ相比,实验Ⅲ使用了催化剂 | |
| C. | 在实验Ⅱ中,反应的平衡常数K=100 | |
| D. | 该反应的△H>0 |
分析 气体压强之比等于气体物质的量之比,结合化学平衡三段式列式计算,设得到平衡状态时消耗PCl3物质的量为x,
PCl3(g)+Cl2(g)?PCl5(g)
起始量(mol) 0.2 0.2 0
变化量(mol) x x x
平衡量(mol) 0.2-x 0.2-x x
A.图象分析可知实验b气体压强160变化为120,60min达到平衡状态,气体压强之比等于气体物质的量之比,0.4:(0.4-x)=160:120,则x=0.1mol,然后依据化学反应速率概念计算;
B.实验Ⅲ跟实验Ⅱ相比,达到相同平衡状态,但时间不同,Ⅲ组改变的实验条件及判断依据是加入了催化剂改变了反应速率;
C.ⅢⅡ是相同平衡状态,平衡时Ⅲ与Ⅱ的各组分的浓度相同,先计算出各组分浓度,然后根据平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$计算;
D.Ⅰ混合气体压强增大,达到平衡时间缩短,所以是升温引起的压强增大.
解答 解:恒温恒容条件下,气体压强之比等于气体物质的量之比,设得到平衡状态时消耗PCl3物质的量为x,
PCl3(g)+Cl2(g)?PCl5(g)
起始量(mol) 0.2 0.2 0
变化量(mol) x x x
平衡量(mol) 0.2-x 0.2-x x
A.图象分析可知实验b气体压强160变化为120,60min达到平衡状态,气体压强之比等于气体物质的量之比,0.4:(0.4-x)=160:120,解得:x=0.1mol,则实验b从反应开始至达到平衡时的反应速率为:v(Cl2)=$\frac{△c}{△t}$=$\frac{\frac{0.1mol}{10L}}{60min}$=1.7×10-4mol/L•min,故A错误;
B.分析图象可知达到平衡状态的时间不同,时间越短反应速率越快,图中3组实验从反应开始至达到平衡时的反应速率v(PCl3)由大到小的次序Ⅲ>Ⅱ>Ⅰ,实验Ⅲ跟实验Ⅱ相比,达到相同平衡状态,但时间不同,Ⅲ组改变的实验条件及判断依据是加入了催化剂改变了反应速率,故B正确;
C.Ⅲ与Ⅱ是相同平衡状态,平衡时各组分的浓度相同,图象分析可知实验Ⅱ气体压强160变化为120,60min达到平衡状态,气体压强之比等于气体物质的量之比,0.4:(0.4-x)=160:120,解得:x=0.1mol,平衡浓度分别为:c( PCl3)=0.01mol/L,c(Cl2)=0.01mol/L,c(PCl5)=0.01mol/L,所以实验a条件下的平衡常数K=$\frac{0.01}{0.01×0.01}$=100,故C正确;
D.Ⅰ混合气体压强增大,达到平衡时间缩短,所以是升温引起的压强增大,但平衡分压减小,故升温平衡向正向移动,正向为吸热反应,故D正确.
故选A.
点评 本题考查了化学平衡的图象及计算,题目难度中等,明确恒温恒容条件下气体物质的量与压强之间的关系为解答关键,注意掌握化学平衡状态特征及应用,试题培养了学生的分析能力及化学计算能力.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 将铜插入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe═2Fe2+ | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+3H+═H2SiO3↓+3Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
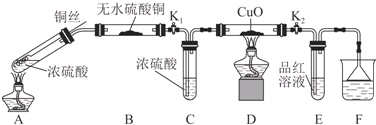
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ① | ② | ③ |
| C | CuO固体 | ④ | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为铜,负极为铁,电解质溶液为FeCl3溶液 | |
| B. | 正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液 | |
| C. | 正极为铂,负极为铁,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为银,负极为铁,电解质溶液为CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
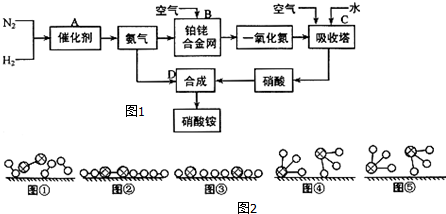
 、
、 、
、 分别表示H2、N2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.
分别表示H2、N2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2O2和Na2S混合物中含有的阴离子数目为0.1NA | |
| B. | pH=13的氢氧化钾溶液,含K+数目约为0.1NA | |
| C. | 标准状况下,5.6LO2作为氧化剂时转移的电子数一定为NA | |
| D. | 18gD2O所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
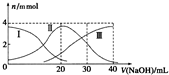 常温下,向20mlH2A溶液中滴加相同物质的量浓度NaOH溶液,有关微粒物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),下列说法正确的是( )
常温下,向20mlH2A溶液中滴加相同物质的量浓度NaOH溶液,有关微粒物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),下列说法正确的是( )| A. | H2A在水中电离方程式为:H2A?2H++A2- | |
| B. | V(NaOH)=20ml时,溶液呈酸性 | |
| C. | V(NaOH)=30mL时,溶液中有以下关系:c(A2-)+c(H2A)+c(HA-)=c(Na+) | |
| D. | V(NaOH)=40mL时,溶液中有以下关系:c(H+)+c(HA-)+c(H2A)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
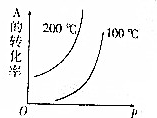 对于可逆反应:mA(g)+nB(g)?pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:
对于可逆反应:mA(g)+nB(g)?pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | U | W | Y | X | 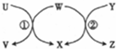 |
| A | Fe | H20 | C | H2 | |
| B | Na | H2O | Na2O2 | NaOH | |
| C | HBr | Cl2 | CH4 | HCl | |
| D | Fe3O4 | Al | NaOH | Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com