
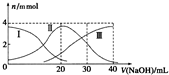
 常温下,向20mlH2A溶液中滴加相同物质的量浓度NaOH溶液,有关微粒物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),下列说法正确的是( )
常温下,向20mlH2A溶液中滴加相同物质的量浓度NaOH溶液,有关微粒物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),下列说法正确的是( )| A. | H2A在水中电离方程式为:H2A?2H++A2- | |
| B. | V(NaOH)=20ml时,溶液呈酸性 | |
| C. | V(NaOH)=30mL时,溶液中有以下关系:c(A2-)+c(H2A)+c(HA-)=c(Na+) | |
| D. | V(NaOH)=40mL时,溶液中有以下关系:c(H+)+c(HA-)+c(H2A)=c(OH-) |
分析 A.H2A在溶液中存在分子,为弱酸,分步电离;
B.根据图象知,当V(NaOH)=20时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,c(A2-)>c(H2A),HA-的电离程度大于HA-的水解程度;
C.当V(NaOH)=30mL时,发生反应为NaOH+H2A=NaHA+H2O,NaHA+NaOH=Na2A+H2O,溶液主要为等物质量的NaHA,Na2A的混合溶液,根据物料守恒分析;
D.当V(NaOH)=40mL时,发生反应为2NaOH+H2A=Na2A+2H2O,溶液中溶质为Na2A,根据质子守恒分析.
解答 解:A.H2A在溶液中存在分子,为弱酸,分步电离,则电离方程式为:H2A?H++HA-、HA-?H++A2-,故A错误;
B.根据图象知,当V(NaOH)=20时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,c(A2-)>c(H2A),HA-的电离程度大于HA-的水解程度,说明溶液显酸性,故B正确;
C.当V(NaOH)=30mL时,发生反应为NaOH+H2A=NaHA+H2O,NaHA+NaOH=Na2A+H2O,溶液主要为等物质量的NaHA,Na2A的混合溶液,物料守恒为3c(HA-)+3c(A2-)+3c(H2A)=2c(Na+),故C错误;
D.当V(NaOH)=40mL时,发生反应为2NaOH+H2A=Na2A+2H2O,溶液中溶质为Na2A,溶液中质子守恒:c(H+)+c(HA-)+2c(H2A)=c(OH-),故D错误.
故选B.
点评 本题考查酸碱混合溶液定性判断,侧重于学生的分析能力的考查,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图象进行分析即可,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢能将是二十一世纪的重要能源,推广应用氢能最关键技术是高容量储氢材料的研制 | |
| B. | 纳米TiO2光触媒技术制成的“木地板精油”能将水气转化为活性氧,由此可推测TiO2光触媒技术制成的“木地板精油可以有效降解甲醛、苯、氨等居室污染物 | |
| C. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强酸、强碱都会“断路” | |
| D. | 门捷列夫提出的元素周期律为发现新元素、合成新材料提供了新思路 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
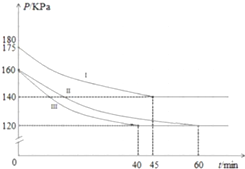 在10L恒容密闭容器中充入PCl3(g)和Cl2(g),发生反应:PCl3(g)+Cl2(g)?PCl5(g)起始时,PCl3(g)和Cl2(g)均为0.2mol,反应分别在Ⅰ、Ⅱ、Ⅲ三种条件下进行,其体系总压强随时间的变化如图所示.下列说法不正确的是( )
在10L恒容密闭容器中充入PCl3(g)和Cl2(g),发生反应:PCl3(g)+Cl2(g)?PCl5(g)起始时,PCl3(g)和Cl2(g)均为0.2mol,反应分别在Ⅰ、Ⅱ、Ⅲ三种条件下进行,其体系总压强随时间的变化如图所示.下列说法不正确的是( )| A. | 在实验Ⅲ中,从反应开始至达到平衡时,v(Cl2)=2.5×10-4mol/(L•min) | |
| B. | 实验Ⅲ跟实验Ⅱ相比,实验Ⅲ使用了催化剂 | |
| C. | 在实验Ⅱ中,反应的平衡常数K=100 | |
| D. | 该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
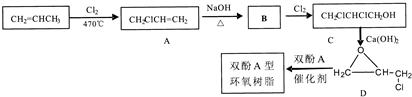
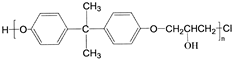
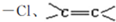 ,C的化学名称为2,3-二氯-1-丙醇.
,C的化学名称为2,3-二氯-1-丙醇.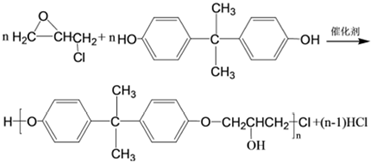
 为起始原料制备
为起始原料制备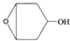 的合成路线:
的合成路线: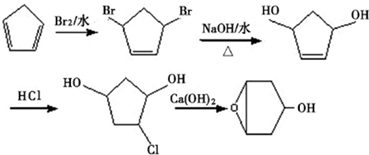 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应前各物质的物质的量/mol | |||
| A | B | C | |
| 甲 | 6 | 2 | 0 |
| 乙 | 0 | 0 | 6 |
| 丙 | 6 | 2 | 6 |
| A. | 带大平衡时,丙中A的溶度是甲中的2倍 | |
| B. | 若反应开始时向容器中加入A为2mol,B为0.5mol,C为3mol,则反应v(正)>v(逆) | |
| C. | 到达平衡时,甲中A的转化率等于乙中C的转化率 | |
| D. | 若保持恒温恒压,达到平衡后再向乙容器中再充入2molC,C的百分含量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
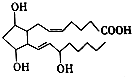 前列腺素F2α(PGF2α)的结构简式如图,下列有关PGF2α说法正确的是( )
前列腺素F2α(PGF2α)的结构简式如图,下列有关PGF2α说法正确的是( )| A. | PGF2α的分子式为C20H32O5 | |
| B. | 1mol PGF2α能与3molH2发生加成反应 | |
| C. | PGF2α不能使酸性高锰酸钾溶液褪色 | |
| D. | PGF2a在浓硫酸的作用下能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
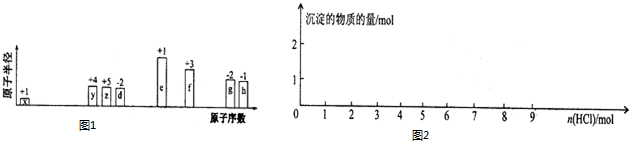
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com