
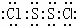 .
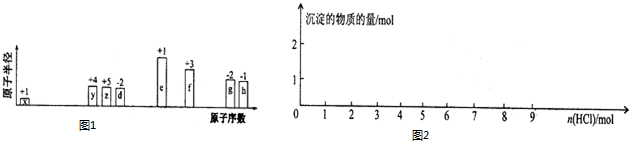
.分析 从图中的化合价和原子半径的大小,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)e是Na元素,在元素周期表的位置是第三周期ⅠA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,O2->Na+>Al3+;
(3)y是C元素,z是N元素,d是O元素,有关说法①氧元素无最高正价,错误;②③C、N、O的非金属性依次增强,气态氢化物的稳定性依次增强,均正确;④单质的活泼性依次增强,错误;,
(4)g是S元素,h是Cl元素①S、Cl非金属性依次增强,最高正价氧化物对应的酸的酸性依次增强,由强到弱的顺序是HClO4>H2SO4;②根据S2Cl2分子中S、Cl的最外层电子数以及可以形成的共价键数目判断,其电子式为 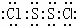
(5)根据NaH+H2O═NaOH+H2↑,3molNaH与水反应可生成3molH2和3molNaOH; 又由2Al+2NaOH+2H2O=2NaAlO2+3H2↑,2molAl反应又可生成3molH2,VH2=6mol×22.4L/mol=134.4L;
往反应后的溶液中加入盐酸,由于NaOH还剩余1mol,先有NaOH+HCl=NaCl+H2O,没有沉淀生成,并消耗盐酸1mol;接着AlO2-+H++H2O=Al(OH)3↓,2molNaAlO2反应生成2mol沉淀,消耗盐酸2mol;最后Al(OH)3↓+3H+=Al3++3H2O,2mol沉淀全部溶解,消耗盐酸6mol;
(6)①工业上采用电解氧化铝生成金属铝和氧气,阳极2O2--4e-=O2↑;
②用Al单质作阳极,Al为活性电极,发生氧化反应,电极反应式为:Al-3e-=Al3+,生成的Al3+再与HCO3-发生双水解,生成Al(OH)3.
解答 解:从图中的化合价和原子半径的大小,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)e是Na元素,在元素周期表的位置是第三周期ⅠA族,故答案为第三周期ⅠA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故答案为:O2->Na+>Al3+;
(3)y是C元素,z是N元素,d是O元素,有关说法①氧元素无最高正价,错误;②③C、N、O的非金属性依次增强,气态氢化物的稳定性依次增强,均正确;④单质的活泼性依次增强,错误,故答案为②③;
(4)g是S元素,h是Cl元素①S、Cl非金属性依次增强,最高正价氧化物对应的酸的酸性依次增强,由强到弱的顺序是HClO4>H2SO4;②根据S2Cl2分子中S、Cl的最外层电子数以及可以形成的共价键数目判断,其电子式为  ,故答案为
,故答案为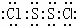 ;
;
(5)根据NaH+H2O═NaOH+H2↑,3molNaH与水反应可生成3molH2和3molNaOH; 又由2Al+2NaOH+2H2O=2NaAlO2+3H2↑,2molAl反应又可生成3molH2,VH2=6mol×22.4L/mol=134.4L;
往反应后的溶液中加入盐酸,由于NaOH还剩余1mol,先有NaOH+HCl=NaCl+H2O,没有沉淀生成,并消耗盐酸1mol;接着AlO2-+H++H2O=Al(OH)3↓,2molNaAlO2反应生成2mol沉淀,消耗盐酸2mol;最后Al(OH)3↓+3H+=Al3++3H2O,2mol沉淀全部溶解,消耗盐酸6mol;故答案为:134.4
(6)①工业上采用电解氧化铝生成金属铝和氧气,阳极2O2--4e-=O2↑;
②用Al单质作阳极,Al为活性电极,发生氧化反应,电极反应式为:Al-3e-=Al3+,生成的Al3+再与HCO3-发生双水解,生成Al(OH)3.
故答案为:①2O2--4e-=O2↑;②Al-3e-+3HCO3-=Al(OH)3↓+3CO2↑.
点评 本题综合性较强,(1)(2)(3)(4)题教基础,考查了原子结构及元素性质的关系,(5)要理清发生的所有反应,(6)考查了电解池的电极反应式书写.


科目:高中化学 来源: 题型:选择题
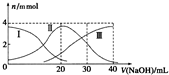 常温下,向20mlH2A溶液中滴加相同物质的量浓度NaOH溶液,有关微粒物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),下列说法正确的是( )
常温下,向20mlH2A溶液中滴加相同物质的量浓度NaOH溶液,有关微粒物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),下列说法正确的是( )| A. | H2A在水中电离方程式为:H2A?2H++A2- | |
| B. | V(NaOH)=20ml时,溶液呈酸性 | |
| C. | V(NaOH)=30mL时,溶液中有以下关系:c(A2-)+c(H2A)+c(HA-)=c(Na+) | |
| D. | V(NaOH)=40mL时,溶液中有以下关系:c(H+)+c(HA-)+c(H2A)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 106g | B. | 90.7g | C. | 77.8g | D. | 66.9g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | U | W | Y | X | 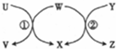 |
| A | Fe | H20 | C | H2 | |
| B | Na | H2O | Na2O2 | NaOH | |
| C | HBr | Cl2 | CH4 | HCl | |
| D | Fe3O4 | Al | NaOH | Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | Z | ||
| X | W |
| A. | 原子半径:Z>Y>X | B. | 气态氢化物的稳定性:X>Z | ||
| C. | Z、W均能与 Mg 形成离子化合物 | D. | 最高价氧化物的水化物的酸性:Y>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
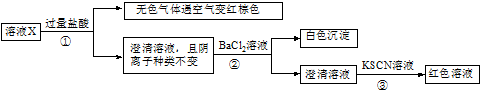
| A. | 无色气体可能是NO和CO2的混合物 | |
| B. | 原溶液可能存在Fe3+ | |
| C. | 溶液X中所含离子种类共有4种 | |
| D. | 另取l00mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为2.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
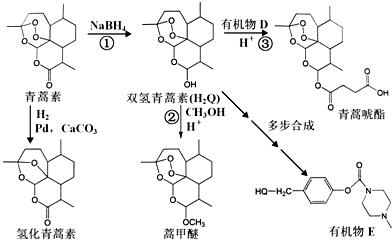
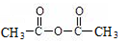 +H-OH→2
+H-OH→2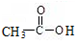
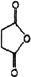 .
.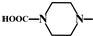 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.写出其中一种的结构简式
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.写出其中一种的结构简式 或
或 或
或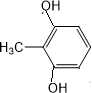 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com