
【题目】已知MnO2与浓盐酸可以发生如下反应: 4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O,若产生7.1gCl2 , 则:
MnCl2+Cl2↑+2H2O,若产生7.1gCl2 , 则:
(1)参加反应的HCl是多少克?
(2)被氧化的HCl是多少克?
(3)参加反应的MnO2物质的量是多少?
【答案】
(1)14.6g
(2)7.3g
(3)0.1mol
【解析】解:(1)设参加反应HCl的质量为m,则:
4HCl(浓)+MnO2 | Cl2↑+2H2O |
146 | 71 |
m | 7.1g |
则m= ![]() =14.6g
=14.6g
答:参加反应HCl的总质量为14.6g.(2)被氧化的HCl生成氯气,根据氯原子守恒,被氧化HCl物质的量=2n(Cl2)=2× ![]() =0.2mol,故被氧化HCl的质量为0.2mol×36.5g/mol=7.3g,
=0.2mol,故被氧化HCl的质量为0.2mol×36.5g/mol=7.3g,
答:被氧化HCl的质量为7.3g.(3)设参加反应MnO2的质量为x,则:
4HCl(浓)+ | MnO2 | Cl2↑+2H2O |
87 | 71 | |
x | 7.1g |
则x= ![]() =8.7g
=8.7g
参加反应MnO2的物质的量为 ![]() =0.1mol,
=0.1mol,
答:参加反应MnO2的物质的量为0.1mol.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol.试回答:
(1)烃A的分子式为
(2)若取一定量的该烃A完全燃烧后,生成CO2和H2O各3mol,则有g烃A参加了反应.
(3)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为(任写1个).
(4)若烃A能使溴水褪色,且核磁共振氢谱显示只有一个峰,请写出其生成高分子化合物的化学方程式 .
(5)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为 .
(6)比烃A少一个碳原子且能使溴水褪色的A的同系物有种同分异构体.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分. 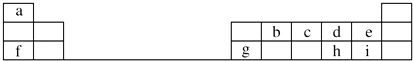
回答下列问题:
(1)元素b在元素周期表中的位置是 .
(2)元素a与c形成的4核10电子分子的化学式为 , 其水溶液呈性.
(3)元素e的负一价离子的结构示意图为 , 元素g的简单离子的结构示意图为 , 二者的离子半径大小顺序为 .
(4)元素i的气态氢化物比元素e的气态氢化物(填“稳定”或“不稳定”).
(5)元素i的单质溶于元素f的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的电子式为 , 该化合物中所含的化学键类型为 .
(6)元素d与h形成的化合物的化学式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在离子RO3n-中共有x个核外电子,R原子的质量数为A,则R原子核内含中子的数目为
A. A+n+48+xB. A-n-24-xC. A-n+24-xD. A+n+24-x
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由H、Na、Mg、S、O、Cl六种元素组成的物质,按要求,每小题各写出一个化学方程式
(1)是化合反应又是氧化还原反应的 .
(2)是分解反应又是氧化还原反应的 .
(3)是氧化还原反应又是置换反应的 .
(4)写出碱性氧化物与水反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
(1)实验I 制取氯酸钾和氯水利用如图所示的实验装置进行实验.
(i)盛放浓盐酸的实验仪器名称是 .
(ii)A中发生反应的化学方程式是 .
(iii)B中生成氯酸钾的离子反应方程式是
(iv)若对调B和C装置的位置,(填“能”或“不能”)提高B中氯酸钾的产率,原因是 .
(2)实验II 测定圆底烧瓶中反应残余液中盐酸的浓度
圆底烧瓶中所发生的反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:采用酸碱中和滴定法测定.
乙方案:与足量Zn反应,测量生成的H2体积.
继而进行下列实验:
①进行甲方案实验:准确量取冷却后的残余清液,稀释一定的倍数后作为试样.
a.量取试样20.00ml,用0.10molL﹣1NaOH标准溶液滴定,到达滴定终点时,消耗标准溶液24.00ml,则该次滴定所测的试样中盐酸浓度为;
b.重复滴定三次后获得实验结果.
②进行乙方案实验:装置如图所示(夹持器具已略去) .
.
(i)使Y形管中的残余清液与锌粒反应的正确操作是将转移到中,否则会造成实验结果偏低.
(ii)反应完毕,读取H2的体积,读数时应注意:a.冷却至室温b.c.视线与凹液面最低处相切.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 红磷、白磷属于同位素B. H2、D2属于同素异形体
C. 4019K、4020Ca互为同位素D. H、D、T互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列叙述,写出元素名称,并写出核外电子排布式.
(1)A元素原子核外M层电子数是L层电子数的一半: .
(2)B元素原子的最外层电子数是次外层电子数的1.5倍: .
(3)C元素的单质在常温下可与水剧烈反应,产生的气体能使带火星的木条复燃: .
(4)D元素的次外层电子数是最外层电子数的 ![]() : .
: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷是制备高纯度磷酸、烟幕弹、燃烧弹等的重要原料,工业上制备白磷的原理之一为4Ca5 (PO4)3F+21Si02+30C3P4+20GaSiO3+30CO↑+SiF4 , 回答相关问题:
(1)基态磷原子的价层电子排布图为 , 上述反应涉及的第二周期元素中第一电离能由大到小的顺序为(用元素符号表示).
(2)上述物质中,中心原子杂化轨道类型为sp3的分子有 , SiF4分子构型为 . 若不考虑C的晶体类型,则上述反应过程消失的晶体类型为 .
(3)碳、硅同一主族,CF4沸点比SiF4低的原因是;碳能形成π键而硅难形成π键的主要原因是 .
(4)图1为硫、磷元素形成的一种分子,分子中每个原子最外层均达到8电子稳定结构,该化合物的分子式为 , 若其晶体中分子的堆积方式与干冰相同,则晶体中每个分子的配位数是 . 
(5)碳、硅两种元素形成的一种高硬度化合物的晶胞如图2所示,若该化合物的密度为ρgcm3 , 晶胞参数为a pm,则阿伏伽德罗常数为mol﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com