
【题目】由H、Na、Mg、S、O、Cl六种元素组成的物质,按要求,每小题各写出一个化学方程式
(1)是化合反应又是氧化还原反应的 .
(2)是分解反应又是氧化还原反应的 .
(3)是氧化还原反应又是置换反应的 .
(4)写出碱性氧化物与水反应的化学方程式 .
【答案】
(1)2Mg+O2![]() 2MgO
2MgO
(2)2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
(3)2Na+2H2O=2NaOH+H2↑
(4)H2O+Na2O=2NaOH
【解析】解:(1)Mg与氧气发生化合反应,且为氧化还原反应,反应为2Mg+O2 ![]() 2MgO,
2MgO,
故答案为:2Mg+O2 ![]() 2MgO;(2)水分解为氧化还原反应,反应为2H2O
2MgO;(2)水分解为氧化还原反应,反应为2H2O ![]() 2H2↑+O2↑,
2H2↑+O2↑,
故答案为:2H2O ![]() 2H2↑+O2↑;(3)钠与水反应为置换氧化反应、且为氧化还原反应,反应为2Na+2H2O=2NaOH+H2↑,
2H2↑+O2↑;(3)钠与水反应为置换氧化反应、且为氧化还原反应,反应为2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;(4)氧化钠与水反应生成NaOH,反应为H2O+Na2O=2NaOH,故答案为:H2O+Na2O=2NaOH.
(1)Mg与氧气发生化合反应,且为氧化还原反应;(2)水分解为氧化还原反应;(3)钠与水反应为置换氧化反应、且为氧化还原反应;(4)氧化钠与水反应生成NaOH.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A. SO2、SiO2、NO2均为酸性氧化物
B. 稀豆浆、硅酸、氯化铁溶液均为胶体
C. 漂白粉、水玻璃、氨水均为混合物
D. Na2O2、Al2O3、Fe3O4均为碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化学反应方程式及反应类型均正确的是( )
选项 | 化学反应方程式 | 反应类型 |
A | CH3COOH+CH3CH2OH | 酯化反应 |
B | CH4+Cl2 | 置换反应 |
C | CH2=CH2+Br2→CH3CHBr2 | 加成反应 |
D |
| 取代反应 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 镭是元素周期表中第ⅡA族元素,下列关于镭的叙述不正确的是
A. 镭比钙的金属性更强 B. 在化合物中呈+2价
C. 镭是一种放射性元素 D. 氢氧化镭呈两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2molL﹣1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法不正确的是( ) 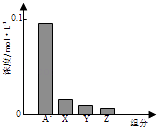
A.HA为弱酸
B.该混合液pH>7
C.图中X表示HA,Y表示OH﹣ , Z表示H+
D.该混合溶液中:c(A﹣)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知MnO2与浓盐酸可以发生如下反应: 4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O,若产生7.1gCl2 , 则:
MnCl2+Cl2↑+2H2O,若产生7.1gCl2 , 则:
(1)参加反应的HCl是多少克?
(2)被氧化的HCl是多少克?
(3)参加反应的MnO2物质的量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾K4[Fe(CN)6],俗名黄血盐,可溶于水,不溶于乙醇.在化学实验、电镀、食品添加剂、烧制青花瓷时可用于绘画等方面有广泛用途.已知HCN是一种极弱的酸,现有一种用含NaCN的废水合成黄血盐的主要工艺流程如下: 
(1)常温下,NaCN水溶液的pH7(填“>”、“<”、“=”),实验室用NaCN固体配制NaCN溶液时,应先将其溶于溶液,再用蒸馏水稀释.
(2)反应器中发生的主要反应的化学方程式为 .
(3)流程中加入Na2CO3溶液后过滤除去弃渣,过滤需要的玻璃仪器有烧杯、漏斗、 .
(4)转化器中生成K4[Fe(CN)6]的反应类型是 , 相同温度下,溶解度:K4[Fe(CN)6]Na4[Fe(CN)6](填“>”“=”“<”),过滤后洗涤K4[Fe(CN)6]使用的试剂是 .
(5)实验室常用K4[Fe(CN)6]检验Fe3+ , 生成难溶盐KFe[Fe(CN)6],试写出上述反应的离子方程式为 .
(6)含有14.7kgNaCN的工业废水可生产出9.2kg的K4[Fe(CN)6],则K4[Fe(CN)6]的产率是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能大量共存的是( )
A. NH4+、SO42-、NO3-、H+ B. I-、NO3-、H+、K+
C. NH4+、Cl-、OH-、NO3- D. Na+、H+、SO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如图1: 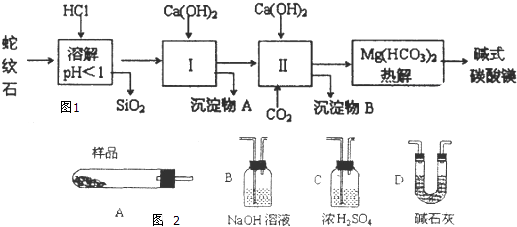
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 .
(2)进行I操作时,控制溶液的pH=7.8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致溶解,产生沉淀.
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 1.9 | 3.3 | 9.4 |
沉淀完全时PH | 3.2 | 5.4 | 12.4 |
(3)从沉淀混合物A中提取红色氧化物作为颜料,先向沉淀物A中加入(填所加物质的化学式),然后、、灼烧(填实验操作名称).灼烧操作需在中进行(填写仪器名称),上述实验中,可以循环利用的物质是(填化学式).
(4)现设计实验,确定产品aMgCO3bMg(OH)2cH2O中a、b、c的值,请写出下列实验步骤中所需要测定的项目(可用试剂:浓硫酸、碱石灰、氢氧化钠溶液、澄清石灰水):①样品称量,②高温分解,③测出水蒸气的质量,④ , ⑤称量MgO的质量.
(5)从下列仪器图2中(装有必要的试剂)中选择完成上述实验所必需的仪器,连接一套装置(选择仪器代号,可重复使用,用“A→B→…→”表示)
(6)18.2g产品完全分解后.产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中 a= , b= , c= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com