
【题目】蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如图1: 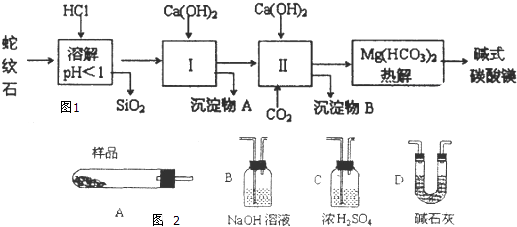
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 .
(2)进行I操作时,控制溶液的pH=7.8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致溶解,产生沉淀.
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 1.9 | 3.3 | 9.4 |
沉淀完全时PH | 3.2 | 5.4 | 12.4 |
(3)从沉淀混合物A中提取红色氧化物作为颜料,先向沉淀物A中加入(填所加物质的化学式),然后、、灼烧(填实验操作名称).灼烧操作需在中进行(填写仪器名称),上述实验中,可以循环利用的物质是(填化学式).
(4)现设计实验,确定产品aMgCO3bMg(OH)2cH2O中a、b、c的值,请写出下列实验步骤中所需要测定的项目(可用试剂:浓硫酸、碱石灰、氢氧化钠溶液、澄清石灰水):①样品称量,②高温分解,③测出水蒸气的质量,④ , ⑤称量MgO的质量.
(5)从下列仪器图2中(装有必要的试剂)中选择完成上述实验所必需的仪器,连接一套装置(选择仪器代号,可重复使用,用“A→B→…→”表示)
(6)18.2g产品完全分解后.产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中 a= , b= , c= .
【答案】
(1)Fe3+、Al3+
(2)Al(OH)3; Mg(OH)2
(3)过滤;洗涤;坩埚; CO2
(4)测出二氧化碳的质量
(5)A→C→D→D
(6)3;1;3
【解析】解:(1)蛇纹石加盐酸溶解,MgO、Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:MgO+2HCl=MgCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,以沉淀的形式除去.所以答案是:Fe3+、Al3+;(2)由(1)知,此时溶液中除了Mg2+外,还含有Fe3+、Al3+杂质,需除去Fe3+、Al3+但不能损失Mg2+,因Fe3++3H2OFe(OH)3+3H+和Al3++3H2OAl(OH)3+3H+,利用平衡移动的原理,消耗H+使上述水解平衡向正反应方向移动,除去Fe3+、Al3+,加Ca(OH)2需将溶液的pH控制在7~8,若pH过高,会导致生成的Al(OH)3发生反应Al(OH)3+OH﹣=AlO2﹣+2H2O溶解,Mg(OH)2在pH为9.4时开始沉淀,所以碱性增强Mg(OH)2会沉淀,同时Mg2+也因转化为沉淀而损失.
所以答案是:Al(OH)3 Mg(OH)2;(3)从实验步骤图知:沉淀混合物为Fe(OH)3和Al(OH)3,红色氧化物是沉淀物Fe(OH)3分解后得到的Fe2O3,所以得先加碱把Al(OH)3除掉,反应为:Al(OH)3+NaOH=NaAlO2+2H2O,然后过滤洗涤灼烧即可;从实验步骤图知:上述实验中,步骤Ⅱ中通二氧化碳,生成碳酸钙,碳酸钙分解可得到二氧化碳,作为第Ⅱ步的原料,碱式碳酸镁分解得到CO2,可以循环使用的物质是CaCO3或CO2.
所以答案是:NaOH或Ca(OH)2;过滤;洗涤;坩埚;CO2;(4)利用碱石灰吸收CO2前后的质量差求二氧化碳质量,所以答案是:测出二氧化碳的质量;(5)加热用A,吸收水蒸气用浓硫酸,用碱石灰吸收二氧化碳,第二个碱石灰可防止空气中的二氧化碳和水进入装置,所以答案是:A→C→D→D;(6)m(样品)=18.2g,m(CO2)=6.6g,m(MgO)=8.0g,碱式碳酸镁分解:aMgCO3bMg(OH)2cH2O ![]() (a+b)MgO+aCO2↑+(b+c)H2O↑,根据质量守恒得:m(H2O)=18.2g﹣6.6g﹣8.0g=3.6g,则m(MgO)═0.2mol,n(CO2)═0.15mol,n(H2O)═0.2mol,得:a:b:c=0.15:0.05:0.15=3:1:3,所以答案是:3,1,3.
(a+b)MgO+aCO2↑+(b+c)H2O↑,根据质量守恒得:m(H2O)=18.2g﹣6.6g﹣8.0g=3.6g,则m(MgO)═0.2mol,n(CO2)═0.15mol,n(H2O)═0.2mol,得:a:b:c=0.15:0.05:0.15=3:1:3,所以答案是:3,1,3.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】由H、Na、Mg、S、O、Cl六种元素组成的物质,按要求,每小题各写出一个化学方程式
(1)是化合反应又是氧化还原反应的 .
(2)是分解反应又是氧化还原反应的 .
(3)是氧化还原反应又是置换反应的 .
(4)写出碱性氧化物与水反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用作软质隐形眼镜材料的聚合物E是: 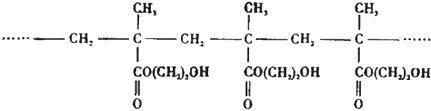
一种合成聚合物 E的路线如下: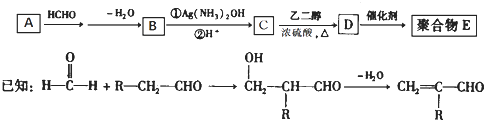
回答下列问题:
(1)A能与新制Cu(OH)2悬浊液反应产生砖红色沉淀,A的结构简式是;
(2)D中含有的官能团名称为:;
(3)D→E的反应类型是反应;
(4)C有多种同分异构体.属于酯且含有碳碳双键的同分异构体共有种(不考虑顺反异构),写出其中核磁共振氢谱峰面积之比为1:1:1:3的同分异构体的结构简式:
(5)写出由乙烯合成乙二醇的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“保护环境”是我国的基本国策。下列做法不应该提倡的是
A. 采取低碳、节俭的生活方式
B. 按照规定对生活废弃物进行分类放置
C. 深入农村和社区宣传环保知识
D. 经常使用一次性筷子、纸杯、塑料袋等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡常用作媒染剂、有机合成中的催化剂,已知SnCl4易水解,溶点为﹣33℃、沸电为114℃.某研究性学习小组设计如图装置(部分夹持装置及加热仪器省略)制备SnCl4 . 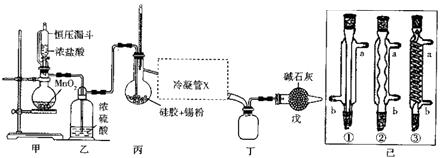
(1)装置甲中反应的离子方程式为 . 整个制备装置中有一处不足,改进的方法是
(2)利用改进后的装置进行实验(下同)时甲、丙均需加热,首先加热的是处的烧瓶,冷凝管x是已中的一种,该仪器的编号是 , 装置戊的用途是 .
(3)实验过程中装置甲中除观察到固体溶解外,还可观察到的明显变化是 .
(4)该小组的甲同学提出,可利用标准NaOH溶液滴定甲中剩余溶液的方法测定出盐酸与MnO2反应的最低浓度.
①滴定时所用指示剂最好是[假设开始出现Mn( OH)2 , 沉淀时的pH约为6,8].
②假设实验时从甲中准确取出V2mL剰余溶液并稀释到V3 mL,然后用0.100 0molL﹣1的 NaOH溶液进行滴定,滴定终点时消耗掉V1mL NaOH溶液,则盐酸与MnO2反应时最低浓度应大于 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷是制备高纯度磷酸、烟幕弹、燃烧弹等的重要原料,工业上制备白磷的原理之一为4Ca5 (PO4)3F+21Si02+30C3P4+20GaSiO3+30CO↑+SiF4 , 回答相关问题:
(1)基态磷原子的价层电子排布图为 , 上述反应涉及的第二周期元素中第一电离能由大到小的顺序为(用元素符号表示).
(2)上述物质中,中心原子杂化轨道类型为sp3的分子有 , SiF4分子构型为 . 若不考虑C的晶体类型,则上述反应过程消失的晶体类型为 .
(3)碳、硅同一主族,CF4沸点比SiF4低的原因是;碳能形成π键而硅难形成π键的主要原因是 .
(4)图1为硫、磷元素形成的一种分子,分子中每个原子最外层均达到8电子稳定结构,该化合物的分子式为 , 若其晶体中分子的堆积方式与干冰相同,则晶体中每个分子的配位数是 . 
(5)碳、硅两种元素形成的一种高硬度化合物的晶胞如图2所示,若该化合物的密度为ρgcm3 , 晶胞参数为a pm,则阿伏伽德罗常数为mol﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以不饱和烃A(相对分子质量为42)、D(核磁共振氢谱只有一个峰)及醇G为基本原料合成聚酯增塑剂F及医药中间体I的路线图如图(部分反应条件略去): 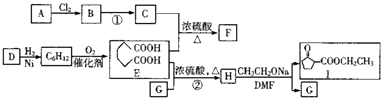
已知: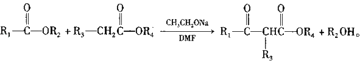
(1)B的名称是 , D的分子式为 , A分子中共平面的原子最多有个.
(2)②的反应类型是 , F的结构简式为 , 1中官能团的名称 .
(3)写出反应①的化学方程式: .
(4)E有多种同分异构体,符合下列条件的同分异构体最多有种,
写出核磁共振氢谱峰面积比为1:1:1:1:6的物质的结构简式: .
①能与NaHCO3反应并放出CO2 , ②能发生水解反应、银镜反应.
(5)参照上述合成路线,以苯甲酸、乙醇、乙酸为原料通过3步转化可合成 ![]() 写出合成路线图.
写出合成路线图.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.
(1)Fe还原水体中NO3﹣的反应原理如图1所示. 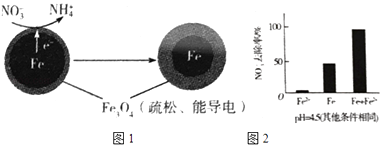
②作负极的物质是 .
②正极的电极反应式是 .
(2)将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如表:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如右图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: . pH=4.5(其他条件相同)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com