
【题目】亚铁氰化钾K4[Fe(CN)6],俗名黄血盐,可溶于水,不溶于乙醇.在化学实验、电镀、食品添加剂、烧制青花瓷时可用于绘画等方面有广泛用途.已知HCN是一种极弱的酸,现有一种用含NaCN的废水合成黄血盐的主要工艺流程如下: 
(1)常温下,NaCN水溶液的pH7(填“>”、“<”、“=”),实验室用NaCN固体配制NaCN溶液时,应先将其溶于溶液,再用蒸馏水稀释.
(2)反应器中发生的主要反应的化学方程式为 .
(3)流程中加入Na2CO3溶液后过滤除去弃渣,过滤需要的玻璃仪器有烧杯、漏斗、 .
(4)转化器中生成K4[Fe(CN)6]的反应类型是 , 相同温度下,溶解度:K4[Fe(CN)6]Na4[Fe(CN)6](填“>”“=”“<”),过滤后洗涤K4[Fe(CN)6]使用的试剂是 .
(5)实验室常用K4[Fe(CN)6]检验Fe3+ , 生成难溶盐KFe[Fe(CN)6],试写出上述反应的离子方程式为 .
(6)含有14.7kgNaCN的工业废水可生产出9.2kg的K4[Fe(CN)6],则K4[Fe(CN)6]的产率是 .
【答案】
(1)>;浓NaOH
(2)6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6]+CaSO4↓+2NaCl
(3)玻璃棒
(4)复分解反应;<;乙醇
(5)K++Fe3++[Fe(CN)6]4﹣=KFe[Fe(CN)6]↓
(6)50%
【解析】解:实验目的是合成黄血盐,由流程可知,NaCN废液中加入硫酸亚铁、氯化钙,发生6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6+CaSO4↓+2NaCl,然后加入碳酸钠溶液可除去过量的Ca2+ , 经过滤后在滤液中加入KCl可转化生成K4[Fe(CN)6 , 说明K4[Fe(CN)6溶解度较小,(1)NaCN为强碱弱酸盐,溶液中CN﹣离子水解溶液呈碱性,NaCN水解呈碱性的离子方程式为:CN﹣+H2OHCN+OH﹣ , 溶液PH>7,为抑制水解,在配制溶液时可将其溶解在氢氧化钠溶液中,在加水稀释,所以答案是:>;浓NaOH;(2)NaCN废液中加入硫酸亚铁、氯化钙,发生反应为:6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6+CaSO4↓+2NaCl,
所以答案是:6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6+CaSO4↓+2NaCl;(3)流程中加入Na2CO3溶液后过滤除去弃渣,过滤需要的玻璃仪器有烧杯、漏斗、玻璃棒,
所以答案是:玻璃棒;(4)经过滤后在滤液中加入KCl可转化生成K4[Fe(CN)6 , KCl+Na4[Fe(CN)6=K4[Fe(CN)6]↓+NaCl,说明K4[Fe(CN)6溶解度较小,反应为复分解反应,亚铁氰化钾K4[Fe(CN)6],俗名黄血盐,可溶于水,不溶于乙醇选择洗涤液,过滤后洗涤K4[Fe(CN)6]使用的试剂是乙醇,
所以答案是:复分解反应;<;乙醇;(5)用K4[Fe(CN)6]检验Fe3+ , 生成难溶盐KFe[Fe(CN)6],反应的离子方程式为:K++Fe3++[Fe(CN)6]4﹣=KFe[Fe(CN)6]↓,
所以答案是:K++Fe3++[Fe(CN)6]4﹣=KFe[Fe(CN)6]↓;(6)含有14.7kgNaCN的工业废水可生产出9.2kg的K4[Fe(CN)6],反应的化学方程式为:6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6+CaSO4↓+2NaCl,KCl+Na4[Fe(CN)6=K4[Fe(CN)6]↓+NaCl,
依据化学方程式定量关系计算理论上生成K4[Fe(CN)6]的质量,
6NaCN | ~ | Na4[Fe(CN)6 | ~ | K4[Fe(CN)6] |
6×49 | 368 | |||
14.7kg | m |
m=18.4kg
则K4[Fe(CN)6]的产率= ![]() ×100%=50%,
×100%=50%,
所以答案是:50%.


科目:高中化学 来源: 题型:
【题目】下列说法中的因果关系正确的是
A.因为氢氟酸显弱酸性,可用于雕刻玻璃
B.因为液态氨气化时吸热,可用液态氨作制冷剂
C.因为明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用
D.用铝制容器盛放浓硝酸,是因为铝和浓硝酸不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由H、Na、Mg、S、O、Cl六种元素组成的物质,按要求,每小题各写出一个化学方程式
(1)是化合反应又是氧化还原反应的 .
(2)是分解反应又是氧化还原反应的 .
(3)是氧化还原反应又是置换反应的 .
(4)写出碱性氧化物与水反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大.A与D同主族,可形成DA型离子化合物,B与C同周期且相邻,C与E同主族,E2﹣与Ar原子具有相同的电子层结构,W的合金用量最大、用途最广.请回答下列问题:
(1)D在元素周期表中的位置 .
(2)A分别与C、E形成最简单化合物中沸点较高的是(填化学式),原因是 .
(3)A、C、D三种元素形成的物质中含有的化学键类型 , 灼热的碳能与B的最高价氧化物对应水化物的浓溶液反应,化学反应方程式为 .
(4)向盛有A2C2溶液的试管中加入几滴酸化的WEC4溶液,溶液变成棕黄色,发生反应的离子方程式为;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是;生成沉淀的原因是(用平衡移动原理解释).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 红磷、白磷属于同位素B. H2、D2属于同素异形体
C. 4019K、4020Ca互为同位素D. H、D、T互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( ) 
A.NH4Al(SO4)2
B.KAl(SO4)2
C.Al2(SO4)3
D.NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用作软质隐形眼镜材料的聚合物E是: 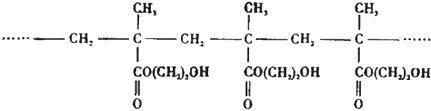
一种合成聚合物 E的路线如下: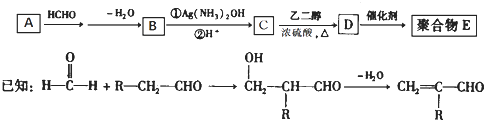
回答下列问题:
(1)A能与新制Cu(OH)2悬浊液反应产生砖红色沉淀,A的结构简式是;
(2)D中含有的官能团名称为:;
(3)D→E的反应类型是反应;
(4)C有多种同分异构体.属于酯且含有碳碳双键的同分异构体共有种(不考虑顺反异构),写出其中核磁共振氢谱峰面积之比为1:1:1:3的同分异构体的结构简式:
(5)写出由乙烯合成乙二醇的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以不饱和烃A(相对分子质量为42)、D(核磁共振氢谱只有一个峰)及醇G为基本原料合成聚酯增塑剂F及医药中间体I的路线图如图(部分反应条件略去): 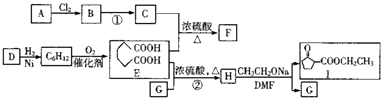
已知: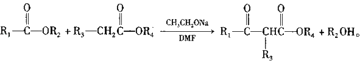
(1)B的名称是 , D的分子式为 , A分子中共平面的原子最多有个.
(2)②的反应类型是 , F的结构简式为 , 1中官能团的名称 .
(3)写出反应①的化学方程式: .
(4)E有多种同分异构体,符合下列条件的同分异构体最多有种,
写出核磁共振氢谱峰面积比为1:1:1:1:6的物质的结构简式: .
①能与NaHCO3反应并放出CO2 , ②能发生水解反应、银镜反应.
(5)参照上述合成路线,以苯甲酸、乙醇、乙酸为原料通过3步转化可合成 ![]() 写出合成路线图.
写出合成路线图.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com