
 MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,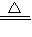 MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;

 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
 HCl+HClO.
HCl+HClO.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||




查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省高三上学期第三次月考化学试卷(解析版) 题型:实验题
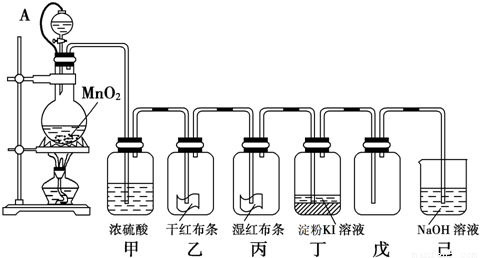
( 10分)“84消毒液”与硫酸溶液反应可以制取氯气(NaClO+ NaCl+H2SO4 Na2SO4 + Cl2↑+H2O) 为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置
Na2SO4 + Cl2↑+H2O) 为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置

(1)从①、②、③装置中选择合适的制气装置(A处)___________ (填写序号)。

(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是__________说明该装置存在明显的缺陷,请提出合理的改进的方法 _______________________________
(3)为了验证氯气的氧化性,将氯气通Na2SO3溶液中,写出氯气与Na2SO3溶液反应的离子方程式 ______________________________________
(4)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有 __________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com