
在某100mL混合酸中,HNO3物质的量浓度为0.4mol.L-1,H2SO4物质的量浓度为0.2mol.L-1。向其中加入足量的铜粉,待充分反应后,溶液中Cu2+物质的量浓度为
| A.0.3mol.L-1 | B.0.225mol.L-1 | C.0.15mol.L-1 | D.无法计算 |
科目:高中化学 来源: 题型:实验题
(15分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O3和NH4NO3产品的流程图如下(Ce为铈元素):
⑴装置Ⅰ中的主要离子方程式为 。3
⑵含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。

①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中个离子由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
⑶写出装置Ⅱ中,酸性条件下的离子方程式 。
⑷装置Ⅲ还可以使Ce4+再生,其原理如下图所示。
①生成Ce4+从电解槽的 (填字母序号)口流出。②写出与阴极的反应式 。
⑸已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示, 计算结果保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
宋代著名法医学家宋慈 的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2="==2" Ag2S +2H2O,其中H2S是
| A.氧化剂 | B.还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应既属于氧化还原反应,又是吸热反应的是
| A.铝与稀盐酸的反应 | B.甲烷在氧气中的燃烧反应 |
| C.灼热的木炭与CO2反应 | D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在热的稀硫酸溶液中溶解11.4g FeSO4。当加入50mL 0.50mol/L KNO3溶液后,使其中的Fe2+全部转化为Fe3+。KNO3溶液也完全反应,并有NxOy气体逸出,此NxOy气体为
| A.N2O | B.N2O3 | C.NO2 | D.NO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
Na2O2、CaC2都能与水反应,且反应中都有气体放出。下列说法正确的是
| A.都属于氧化还原反应 | B.生成的气体均为氧化产物 |
| C.反应物水均作氧化剂 | D.反应均放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
甲乙两种非金属,能说明甲比乙的非金属性强的是( )
①甲比乙容易与H2化合;②甲的气态氢化物比乙的气态氢化物稳定;③甲的氧化物对应的水化物的酸性比乙的氧化物对应的水化物酸性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低。
| A.①②③ | B.只有⑤ | C.①②③④⑤ | D.①② |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O;Cl2+2FeCl2===2FeCl3;
2KI+2FeCl3===2KCl+I2+2FeCl2。则下列判断错误的是
A.氧化性:MnO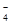 >Cl2>Fe3+ >I2 >Cl2>Fe3+ >I2 |
| B.FeCl3既有氧化性又有还原性 |
| C.向FeI2溶液中通入少量的Cl2,发生反应的方程式为6FeI2+3Cl2=2FeCl3+4FeI3 |
| D.FeCl3能使湿润的淀粉碘化钾试纸变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
R、X、Y、Z是四种元素,其常见化合价均为+2,且X2+与单质R不反应;X2++Z=X+Z2+,Y+Z2+=Y2++Z,这四种离子被还原成0价时表现的氧化性大小顺序为( )
| A.R2+﹥X2+﹥Z2+﹥Y2+ | B.X2+﹥R2+﹥Y2+﹥Z2+ |
| C.Y2+﹥Z2+﹥R2+﹥X2+ | D.Z2+﹥X2+﹥R2+﹥Y2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com